Annual Report on Spontaneous Reporting of Adverse Drug Reactions for 2012 - Croatian Document
- Uvod
- 1. Prijave nuspojava u 2012. godini
- 1.1. Izvori prijava
- 1.2. Karakteristike prijava nuspojava lijekova i cjepiva
- 1.2.1. Klasifikacija lijekova
- 1.2.2. Dob i spol bolesnika
- 1.2.3. Vrste nuspojava
- 1.2.4. Broj lijekova u istovremenoj primjeni
- 1.2.5. Ozbiljnost nuspojave
- 1.2.6. Ishod nuspojave
- 1.2.7. Nuspojave po organskim sustavima
- 1.2.8. Najčešće prijavljene nuspojave u 2012. godini
- 2. Prijave nuspojava od strane pacijenata/korisnika lijeka
- 3. Pregled sigurnosnih pitanja u 2012. godini
- 3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2012. godini
- 3.1.1. Aliskiren
- 3.1.2. Boceprevir
- 3.1.3. Paracetamol
- 3.1.4. Stroncijev ranelat
- 3.1.5. Tiamazol
- 3.1.6. Ondanzetron
- 3.1.7. Trimetazidin
- 3.1.8. Fitomenadion
- 3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2012. godini
- 3.2.1. Prijave sumnji na neurološke nuspojave cjepiva protiv gripe Fluimun i Focetria
- 3.2.2. Početak ponovne proizvodnje otopina za peritonejsku dijalizu Dianeal, Extraneal i Nutrineal u tvornici u Castlebaru u Irskoj
- 3.2.3. Kontinuirani nadzor HALMED-a nad sigurnošću primjene lijekova iz uvoza
- 3.2.4. Rad HALMED-a na poticanju prijava nuspojava od strane pacijenata
Uvod
Na temelju Zakona o lijekovima (Narodne novine, br. 71/07., 45/09. i 124/11.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 125/09.) Agencija za lijekove i medicinske proizvode (u daljnjem tekstu: HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje gotovog lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave nuspojava lijekova od pacijenata. HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je osmo (8.) izvješće o prijavama nuspojava zaprimljenima iz Republike Hrvatske koje je izradio HALMED.
1. Prijave nuspojava u 2012. godini
Tijekom 2012. godine HALMED je zaprimio ukupno 1923 prijave nuspojava u Republici Hrvatskoj.
Ukupan broj prijava nuspojava u 2012. godini u Republici Hrvatskoj čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave nuspojava izravno prijavljene HALMED-u od strane zdravstvenih radnika
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje gotovog lijeka u promet koje su zaprimili od zdravstvenih radnika ili pacijenata
- prijave nuspojava izravno prijavljene HALMED-u od strane pacijenata/korisnika lijeka
- spontanih prijava nuspojava cjepiva zaprimljenih u HALMED-u:
-
- prijava nuspojava na cjepiva koje zaprima Hrvatski zavod za javno zdravstvo (HZJZ) i prosljeđuje HALMED-u
- prijava nuspojava cjepiva koje je HALMED izravno primio od zdravstvenih radnika, nositelja odobrenja ili pacijenata
- prijava nuspojava dodataka prehrani
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR-a) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj.
Broj prijava iz svake od ovih skupina prikazan je u Tablici 1, a njihov udio na Slici 1.
Tablica 1. Prijave nuspojava po skupinama proizvoda (ukupan broj)
| Skupine | Lijekovi | Cjepiva | Dodaci prehrani | SUSAR* | UKUPNO |
|---|---|---|---|---|---|
| Broj prijava | 1737 | 129 | 20 | 37 | 1923 |
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Slika 1. Udio prijava nuspojava po skupinama proizvoda
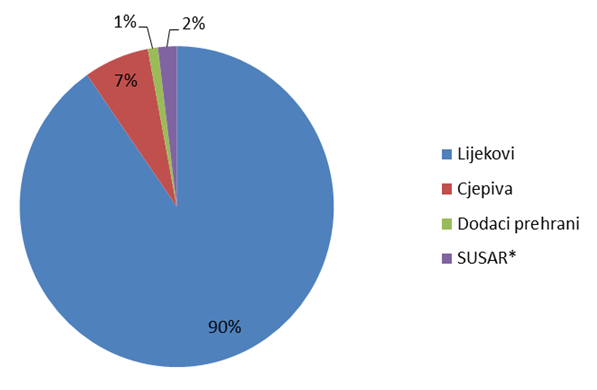
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Tijekom 2012. godine HALMED je zaprimio ukupno 1923 prijava sumnji na nuspojave u Republici Hrvatskoj. Od tog broja, 45 prijava dobiveno je iz objavljenih literaturnih podataka o nuspojavama zabilježenima u Republici Hrvatskoj, 94 prijave su iz kliničkih ispitivanja ili postmarketinških neintervencijskih ispitivanja, dok su 1784 prijave prikupljene spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika i pacijenata izravno HALMED-u, preko nositelja odobrenja za stavljanje gotovog lijeka u promet ili od Hrvatskog zavoda za javno zdravstvo. Ukupno 45 prijava nuspojava lijekova zaprimljeno je od pacijenata/korisnika lijeka/zakonskih zastupnika koji su nuspojavu prijavili izravno HALMED-u.
Ključni zaključci razmatranja dobivenih podataka su sljedeći:
- Ukupan broj prijava zabilježio je blagi pad od 6% u odnosu na 2011. godinu (1923 prijave prema 2040 u 2011. godini)
- Šezdeset i tri posto (63%) svih prijava sumnji na nuspojave u 2012. godini zaprimljeno je od liječnika, nešto manje nego u 2011. godini kad su liječnici bili izvor 65% prijava.
- Udio prijava od strane ljekarnika je porastao je na 30% u 2012. godini (24% u 2011. odnosno 20% u 2010. godini).
- Broj prijava zaprimljenih od strane pacijenata u 2012. godini je 45, što čini nešto više od 2% svih prijava.
- Među pošiljateljima prijava HALMED-u, udio nositelja odobrenja za stavljanje lijeka u promet ostao je jednak udjelu iz 2011. godine i iznosi 34%.
- U 2012. godini osjetno je veći broj prijava za one nuspojave koje ne udovoljavaju kriterijima ozbiljne nuspojave (56% prema 44% ozbiljnih nuspojava).
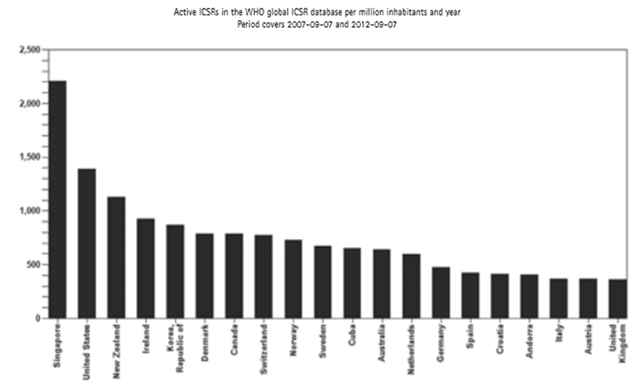
Kao što se naglašavalo i u Izvješćima za prethodne godine, broj prijava sumnji na nuspojave je indikator kvalitete samog sustava prijavljivanja nuspojava. Zahvaljujući zajedničkim naporima HALMED-a i svih zdravstvenih radnika, pacijenata i nositelja odobrenja za lijekove koji redovito prijavljuju sumnje na nuspojave, Republika Hrvatska se, po kvaliteti i broju prijava nuspojava, izraženo na milijun stanovnika, u 2012. godini smjestila na visokom 16. mjestu od 110 zemalja svijeta koje sudjeluju u programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO) s oko 500 prijava na milijun stanovnika. U prvih 20 mjesta smjestilo se 13 europskih zemalja, od kojih je Hrvatska na devetom mjestu. Visoka mjesta koja zauzimaju Singapur i Novi Zeland rezultat su prikupljanja sumnji na nuspojave izravno iz elektronskih kartona pacijenata i baze propisivanja lijekova što je različito u odnosu na način prikupljanja prijava nuspojava u Europi gdje se prvenstveno radi o spontanom prijavljivanju od strane zdravstvenih radnika i pacijenata.
Slika 2. preuzeta je iz publikacije Uppsala Reports (broj 59) koju izdaje Uppsala Monitoring Centre (UMC) - centar za praćenje nuspojava Svjetske zdravstvene organizacije (SZO) za razdoblje rujan 2007. - rujan 2012. godine (http://www.who-umc.org/graphics/27164.pdf).
Slika 2. Broj prijava nuspojava na milijun stanovnika u bazi Svjetske zdravstvene organizacije (Uppsala Monitoring Centre - VigiBase), rujan 2007. - rujan 2012. godine
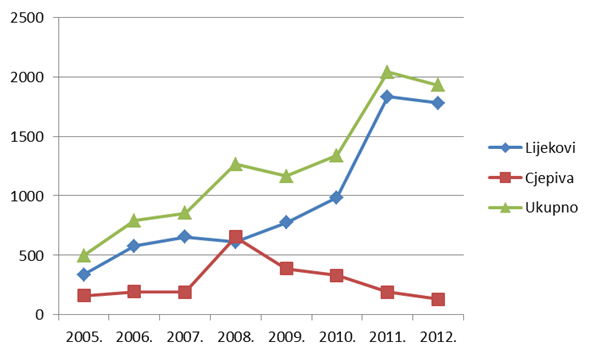
Tablica 2. Kretanje ukupnog broja prijava nuspojava (uključujući SUSAR) u Republici Hrvatskoj u posljednjih osam godina (2005. - 2012.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. |
|---|---|---|---|---|---|---|---|---|
| Ukupan broj prijava nuspojava | 498 | 790 | 856 | 1265 | 1165 | 1338 | 2040 | 1923 |
Tablica 3. Kretanje broja spontanih prijava nuspojava na lijekove i cjepiva u Republici Hrvatskoj u posljednjih osam godina (2005. - 2012.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. |
|---|---|---|---|---|---|---|---|---|
| Lijekovi | 336 | 579 | 655 | 611 | 776 | 983 | 1831 | 1737 |
| Cjepiva | 162 | 194 | 192 | 654 | 389 | 331 | 191 | 129 |
Slika 3. Kretanje broja prijava nuspojava u Republici Hrvatskoj u posljednjih osam godina (2005. - 2012.)
U 2012. godini HALMED je nastavio održavati radionice za zdravstvene radnike i odgovorne osobe za farmakovigilanciju nositelja odobrenja putem kojih ih educira o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj te o načinu i značaju prijavljivanja sumnji na nuspojave. Održane su tri radionice na kojima je sudjelovalo ukupno 134 polaznika. Od rujna 2005. do kraja 2012. godine HALMED je održao ukupno 89 radionica iz područja farmakovigilancije koje je pohađalo i uspješno završilo gotovo 1600 zdravstvenih radnika.
1.1. Izvori prijava
Gotovo dvije trećine prijava sumnji na nuspojave lijekova HALMED-u su u 2012. godini uputili liječnici; u ovoj je godini nešto više prijava zaprimljeno od strane liječnika bez specijalizacije, odnosno liječnika koji rade u primarnoj zdravstvenoj zaštiti. Broj prijava od strane ljekarnika je u 2012. godini porastao za 21% u odnosu na 2011. godinu te prijave iz ovog izvora čine gotovo trećinu svih primarnih prijavitelja.
Najveća promjena u 2012. godini je gotovo trostruki porast broja prijava od strane pacijenata u odnosu na 2011. godinu. Tijekom 2012. godine, HALMED je zaprimio 45 prijava od pacijenata/korisnika lijeka ili njihovih zakonskih zastupnika (Tablica 4.). Prijavljivanje od strane pacijenata/korisnika lijekova ili njihovih zakonskih zastupnika omogućeno je Pravilnikom o farmakovigilanciji iz 2009. godine, a posebno olakšano implementacijom aplikacije UMC-a namijenjene upravo u ovu svrhu. Time se Republika Hrvatska svrstala u uski krug europskih zemalja koje imaju takav vid prijavljivanja od strane pacijenata (svega četiri europske zemlje su implementirale internetsku aplikaciju za prijavljivanje nuspojava od strane bolesnika, što je obveza svih nacionalnih nadležnih tijela prema novoj europskoj legislativi na području farmakovigilancije, čija je većina odredbi stupila na snagu 2012. godine).
Slika 4. On-line aplikacija Uppsala Monitoring Centra kojom se pacijentima omogućuje aktivno i jednostavno sudjelovanje u praćenju sigurnosti primjene lijekova dostupna je na internetskim stranicama HALMED-a (www.halmed.hr)

HALMED je zaprimio 659 prijava od strane nositelja odobrenja za stavljanje gotovog lijeka u promet, što čini 34% ukupnog broja prijava. To je u Izvješćima HALMED-a najveći zabilježeni udio u ukupnom broju prijava od strane nositelja odobrenja, što pokazuje da nositelji odobrenja ozbiljno shvaćaju svoju ulogu u praćenju i nadziranju sigurnosnog profila svojih lijekova na tržištu.
Tablica 4. Izvori prijava sumnji na nuspojave lijekova i cjepiva u 2012. godini prema struci prijavitelja
| Izvor prijave | Broj prijava |
|---|---|
| Liječnici (bez specijalizacije) | 605 |
| Liječnici specijalisti | 435 |
| Farmaceuti | 595 |
| Pacijenti/korisnici lijeka (ili njihovi zakonski zastupnici) | 45 |
| Medicinske sestre | 20 |
| Medicinski i farmaceutski tehničari | 2 |
| Stomatolozi | 1 |
| Nepoznat izvor (zdravstveni radnici nepoznatog profila) | 220 |
| UKUPNO SPONTANIH PRIJAVA: | 1923 |
Slika 5. Kretanje broja prijava prema primarnom izvoru prijava od 2005. do 2012. godine
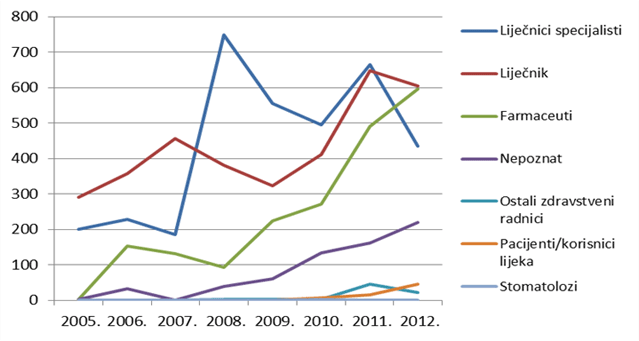
Slika 5. i Tablica 4. zorno prikazuju i neke od izazova u održavanju i izgradnji sustava praćenja sigurnosti primjene lijekova: prvi izazov je porast broja prijava koji pripadaju kategoriji "nepoznat izvor prijave" (poznato je da se radi o zdravstvenim radnicima, ali nije poznat njihov profil). Radi se o kategoriji koja se najčešće javlja kada je pošiljatelj prijave nositelj odobrenja koji ne specificira profil zdravstvenih radnika prijavitelja.
Drugi izazov je pitanje liječnika specijalista i njihove uloge u sustavu praćenja sigurnosti primjene lijekova: vidljivo je da se radi o dijelu sustava koji je izrazito osjetljiv na određenu intervenciju u sustav (npr. uvođenje novog cjepiva u obvezni program cijepljenja), ali se učinak intervencije relativno brzo gubi. Zadaća je HALMED-a osigurati trajnu participaciju liječnika specijalista u sustavu, kako kroz dodatne edukacije u predstojećoj godini, tako i kroz osiguravanje novih elektroničkih aplikacija namijenjenih ciljnoj kategoriji prijavitelja.
Slika 6. Udio prijava pojedinih struka zdravstvenih radnika od 2005. do 2012. godine
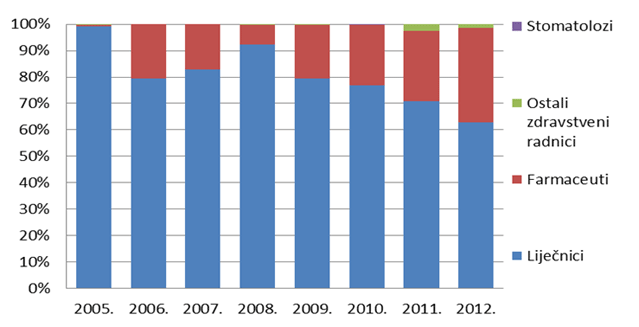
Slika 6. pokazuje udio pojedinih zdravstvenih radnika u prijavljivanju nuspojava u kojem tradicionalno dominiraju liječnici. Od 2008. godine, svjedoci smo porasta broja prijava od strane farmaceuta koji je u prošloj godini dosegao 31%, što Hrvatsku svrstava uz bok nekim od najrazvijenijih farmakovigilancijskih sustava u svijetu. Prijave od strane medicinskih sestara i tehničara, farmaceutskih tehničara i stomatologa su, nažalost, još uvijek malobrojne stoga HALMED planira dodatne edukacije za navedene skupine zdravstvenih radnika u svrhu poticanja prijavljivanja nuspojava kao i dogovora s komorama o dodatnim stimulacijama kroz bodove za trajnu edukaciju kako za liječnike, tako i za farmaceute.
Udio broja prijava iz bolničkih ustanova pao je s 32% u 2011. na 16% u 2012. godini (Tablica 5.). Razlozi za ovaj pad broja prijava iz bolničkih ustanova već su obrađeni u gornjim odlomcima a usko su vezani uz participaciju liječnika specijalista u sustavu praćenja sigurnosti primjene lijekova. Ponovno treba naglasiti da se najveći broj ozbiljnih nuspojava događa u bolnicama jer je po definiciji nuspojava ozbiljna ako uzrokuje hospitalizaciju, odnosno ako produžuje bolničko liječenje. Također je uočljiv pad broja prijava zaprimljenih iz pedijatrijskih ordinacija jer su prijave ranijih godina bile gotovo isključivo prijave za cjepiva (u najvećoj mjeri su se ranije odnosile na cjepivo protiv parotitisa). Zabrinjava činjenica da nema prijava nuspojava od strane pedijatara za konvencionalne lijekove koje se javljaju u djece, a koje su iznimno važne za praćenje sigurnosnog profila lijekova koji se daju u dječjoj populaciji. Radi se o pojavi koja je globalna i nije specifična samo za Republiku Hrvatsku te i nova farmakovigilancijska regulativa za područje Europske unije pridaje dodatnu pažnju ovoj problematici kako bi se trend prijavljivanja povećao dodatnim edukacijskim materijalima za zdravstvene radnike i roditelje djece.
Tablica 5. Izvori prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2012. godini
| Ustanova | Broj prijava |
|---|---|
| Ljekarne | 567 |
| Klinička bolnica ili Klinički bolnički centar | 165 |
| Opće bolnice | 88 |
| Specijalna bolnica | 37 |
| Ordinacije obiteljske medicine | 227 |
| Hrvatski zavod za javno zdravstvo | 25 |
| Županijski zavodi za javno zdravstvo | 61 |
| Pedijatrijska ordinacija | 33 |
| Psihijatrijska ordinacija | 29 |
| Ordinacija školske medicine | 2 |
| Ostalo | 39 |
| Nepoznato | 650 |
| UKUPNO PRIJAVA: | 1923 |
Slika 7. Udio pojedinih ustanova kao izvor prijavljivanja nuspojava u 2012. godini
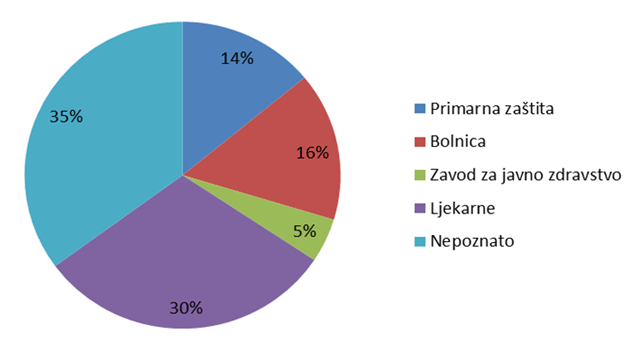
Slika 7. prikazuje udio pojedinih ustanova u prijavljivanju nuspojava. U primarnu zdravstvenu zaštitu uračunate su prijave ordinacija obiteljske medicine, ginekoloških i pedijatrijskih ordinacija, a u bolničku zaštitu sve vrste bolnica i bolničkih centara. Posebno su izdvojeni zavodi za javno zdravstvo, koji su važni u sustavu prijavljivanja nuspojava cjepiva, te ljekarne. Ukupno 35% ustanova nije identificirano kroz prijavu, što je posljedica povećanog broja prijava od strane nositelja odobrenja gdje navedena informacija u određenim slučajevima nedostaje iz razloga što elektronički sustavi pojedinih nositelja odobrenja ne prosljeđuju ovu informaciju. HALMED će učiniti sve kako bi se ovaj problem riješio što prije jer bitno utječe na kvalitetu sustava i planiranje aktivnosti za njegovo unapređenje.
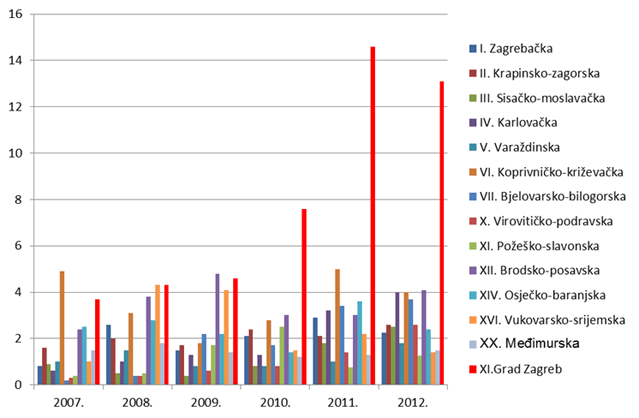
HALMED je i u 2012. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. Najviše prijava zaprimljeno je s područja Grada Zagreba - 1039, slijede Splitsko-dalmatinska županija i Osječko-baranjska (71 prijava) te Zagrebačka županija (70 prijava).
Tablica 6. Broj prijava nuspojava prema županijama u 2012. godini
| Županija | Broj prijava u 2012. godini | Broj prijava na 10 000 stanovnika u 2012. godini |
|---|---|---|
| I. Zagrebačka | 70 | 2,25 |
| II. Krapinsko-zagorska | 34 | 2,6 |
| III. Sisačko-moslavačka | 42 | 2,5 |
| IV. Karlovačka | 52 | 4 |
| V. Varaždinska | 31 | 1,8 |
| VI. Koprivničko-križevačka | 44 | 4 |
| VII. Bjelovarsko-bilogorska | 44 | 3,7 |
| VIII. Primorsko-goranska | 106 | 3,5 |
| IX. Ličko-senjska | 7 | 1,4 |
| X. Virovitičko-podravska | 21 | 2,6 |
| XI. Požeško-slavonska | 10 | 1,25 |
| XII. Brodsko-posavska | 65 | 4,1 |
| XIII. Zadarska | 58 | 3,4 |
| XIV. Osječko-baranjska | 71 | 2,4 |
| XV. Šibensko-kninska | 14 | 1,3 |
| XVI. Vukovarsko-srijemska | 25 | 1,4 |
| XVII. Splitsko-dalmatinska | 71 | 1,6 |
| XVIII. Istarska | 57 | 2,7 |
| XIX. Dubrovačko-neretvanska | 16 | 1,3 |
| XX. Međimurska | 17 | 1,5 |
| Grad Zagreb | 1039 | 13,1 |
| UKUPNO PRIJAVA: | 1923 | 4,5 |
Prosječan broj prijava izražen na 10 000 stanovnika za cijelu Republiku Hrvatsku bio je neznatno niži u 2012. u odnosu na 2011. godinu - za 0,1 prijavu - te je iznosio 4,5 prijava. U odnosu na prosjek Republike Hrvatske, samo je Grad Zagreb zabilježio iznadprosječni rezultat s 13,1 prijavom na 10 000 stanovnika, dok su sve druge županije ispod državnog prosjeka. Razlog velikog broja prijava iz Grada Zagreba rezultat je činjenice da su sjedišta nositelja odobrenja upravo u Zagrebu, ali to ne znači i istodobno da su stvarne prijave došle iz neke druge županije od primarnog prijavitelja - zdravstvenog radnika prema nositelju odobrenja. Ovi podaci nisu vidljivi u navedenim prijavama jer su u gotovo svim slučajevima u prijavama HALMED-u anonimizirani.
Na temelju ovih podataka HALMED će i dalje planirati održavanje Radionica o ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske.
Slika 8. Broj prijava na 10 000 stanovnika po županijama za razdoblje 2007. - 2012. godine (Kontinentalna Hrvatska)
Slika 9. Broj prijava na 10 000 stanovnika po županijama za razdoblje 2007. - 2012. godine (Jadranska Hrvatska)
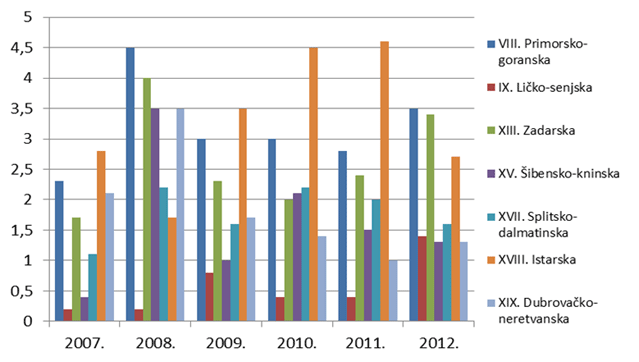
U sub-analizi broja prijava na 10.000 stanovnika za Jadransku Hrvatsku bio je vidljiv izraziti porast u Istarskoj županiji do 2011. godine zahvaljujući nekolicini prijavitelja iz pulske bolnice, prvenstveno transfuziologa koji prate nuspojave varfarina i mogućnost individualizacije terapije i smanjenja broja nuspojava ovog lijeka uključivanjem pretraga iz farmakogenomike prije započinjanja terapije kako bi na taj način uspješno spriječili razvoj ozbiljnih nuspojava kao što su krvarenja.
1.2. Karakteristike prijava nuspojava lijekova i cjepiva
Tablica 7. Apsolutni broj lijekova za koje je prijavljena sumnja na nuspojave prema Anatomsko- Terapijsko-Kemijskoj (ATK) klasifikaciji
| ATK klasifikacija | 2012. |
|---|---|
| ATK 1. razina A skupina (probavni sustav) | 204 |
| ATK 1. razina B skupina (učinak na krv) | 94 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 422 |
| ATK 1. razina D skupina (dermatici) | 39 |
| ATK 1. razina G skupina (urogenitalni sustavi spolni hormoni) | 102 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 39 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 375 |
| ATK 1. razina L skupina (citostatici) | 318 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 83 |
| ATK 1. razina N skupina (živčani sustav) | 641 |
| ATK 1. razina P skupina (parazitne infekcije) | 2 |
| ATK 1. razina R skupina (respiratorni sustav) | 73 |
| ATK 1. razina S skupina (pripravci za osjetila) | 41 |
| ATK 1. razina V skupina (različito) | 27 |
| UKUPNO LJEKOVA: | 2460 |
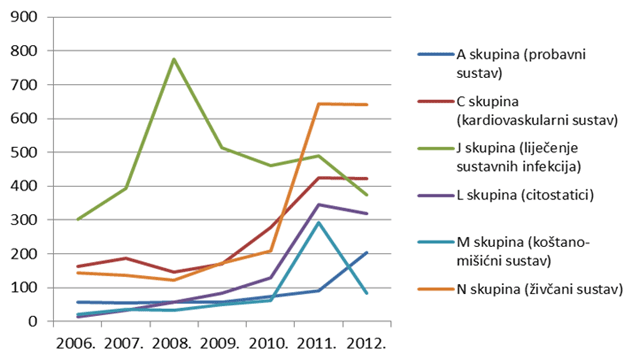
Tri najzastupljenije skupine lijekova iz prethodnih godina prema udjelu u broju prijava nuspojava ostale su na vrhu i tijekom 2012. godine, ali su prema apsolutnom broju zabilježile ili stagnaciju (skupine N,C) ili pad broja prijava (skupina J). Ukupan broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava jer se u jednoj prijavi mogu naznačiti sumnje na nuspojave više lijekova (Tablica 7.).
Iz Slike 10. uočljiv je izraziti trend pada broja prijava za lijekove iz skupine J, što je izravna posljedica manjeg broja prijava za cjepiva (vrhunac broja prijava za ovu skupinu iz 2008. godine koincidira s uvođenjem peterovalentnog cjepiva protiv difterije, tetanusa, hripavca, poliomijelitisa i hemofilusa tip b).
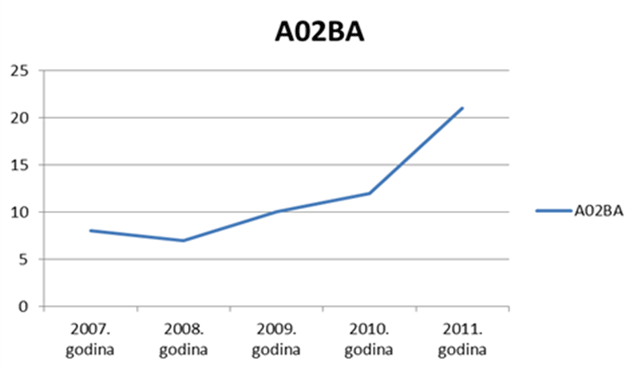
Također, u 2012. godini uočavamo porast broja prijava za skupinu A (lijekovi za probavni sustav), što možemo objasniti prelaskom dijela lijekova iz ove skupine na bezreceptni režim propisivanja (Slika 11. prikazuje izražen skok korištenja lijekova iz podskupine A02BA - pripravci za liječenje peptičkog ulkusa i GERB-a - antagonisti H2 receptora u koje, između ostalog, spadaju i ranitidin te famotidin, na prijelazu iz 2010. na 2011. godinu, za koji držimo da se nastavio i u 2012. godini (podaci o ukupnoj potrošnji za 2012. godinu bit će poznati sredinom 2013. godine).
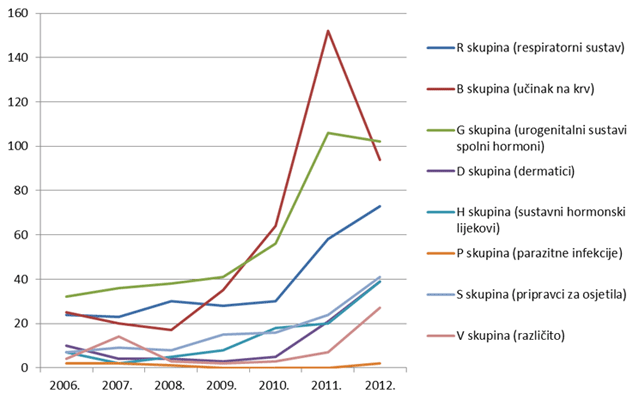
Zanimljivo je pratiti i manje zastupljene lijekove, od kojih većina pokazuje trend rasta broja prijava u posljednjih nekoliko godina (Slika 12.).
Slika 10. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2012. godine za skupinu najzastupljenijih lijekova
Slika 11. Porast korištenja lijekova iz podskupine A02BA izražen u DDD/1000 stanovnika/dan
Slika 12. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2012. godine za skupinu manje zastupljenih lijekova
Tablica 8. Prijave sumnji na nuspojave lijekova prema dobi bolesnika za 2012. godinu
| Dob bolesnika | Broj prijava u 2012. godini |
|---|---|
| Do 12 mjeseci | 16 |
| 1 do 2 godine | 22 |
| 3 do 6 godina | 36 |
| 7 do 14 godina | 71 |
| 15 do 17 godina | 17 |
| 18 do 40 godina | 336 |
| 41 do 64 godine | 647 |
| 65 do 74 godina | 314 |
| 75 do 84 godina | 170 |
| 85 godina i starije | 25 |
| Neupisana dob | 269 |
| UKUPNO: | 1923 |
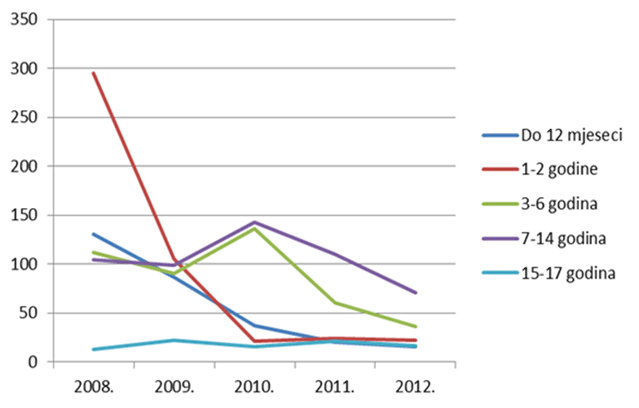
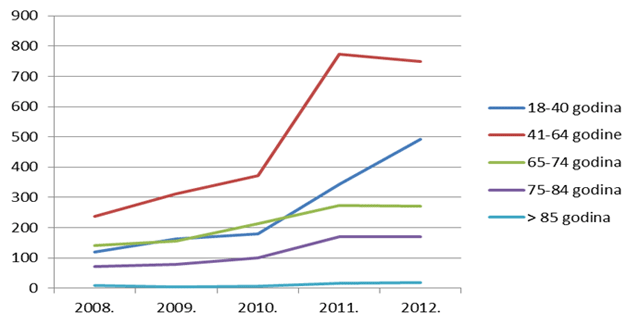
Kako se može uočiti na slikama 13. i 14., izražen je trend pada broja prijava sumnji na nuspojave u mlađim dobnim kategorijama - zabilježeni su višegodišnji minimumi u 2012. godini za većinu mlađih dobnih kategorija, što pripisujemo nastavku pada broja prijava sumnji na nuspojave cjepiva. Za središnje dobne skupine, kao i za one najstarije, u prošloj godini je uočena stagnacija, izuzev skupine od 18 do 40 godina koja pokazuje trend rasta koji se nastavio i u 2012. godini.
Slika 13. Pregled kretanja broja prijava za mlađe dobne kategorije u razdoblju od 2008. do 2012. godine
Slika 14. Pregled kretanja broja prijava za starije dobne kategorije u razdoblju od 2008. do 2012. godine
Slika 15. Prijave sumnji na nuspojave prema spolu bolesnika u 2012. godini
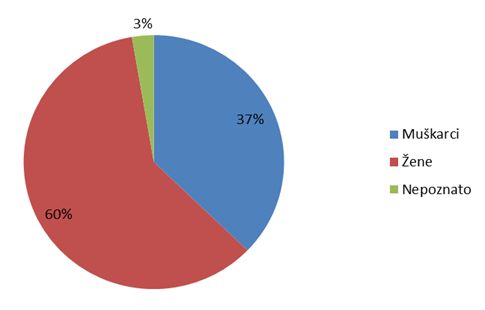
Statistika koju HALMED vodi za sumnje na nuspojave lijekova već osmu godinu zaredom pokazuje da je značajno veći broj prijava sumnji na nuspojavu zabilježen kod osoba ženskog spola, što je i karakteristika nađena u svjetskoj i europskoj bazi nuspojava (Slika 15.).
Nuspojave se osnovno dijele na nuspojave tipa A (posljedica pretjeranog farmakološkog učinka) i nuspojave tipa B, u koje spadaju imunoalergijske reakcije, pseudoalergijske reakcije, metabolička intolerancija i idiosinkrazije. Od ukupno 5198 prijavljenih nuspojava, u 781 slučaju možemo govoriti o reakcijama tipa B, što čini 14% svih nuspojava, neznatno manje nego u 2011. godini. Iz Tablice 9. je vidljiva poprilična ujednačenost udjela pojedinih tipova nuspojava kroz petogodišnje razdoblje.
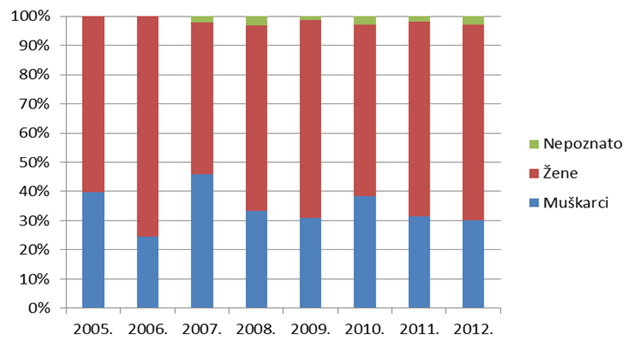
U uzorku iz 2012. godine među osobama kod kojih se javljaju nuspojave tipa B dominiraju osobe ženskog spola. U 3% prijava spol nije bio poznat (Tablica 10.).
Nakon porasta broja nuspojava tipa F (nedjelotvornost lijeka) u 2011. godini na 4%, u 2012. godini taj je postotak iznosio 2% svih nuspojava. Uobičajeno nakon takvih prijava slijedi regulatorna akcija provjere kakvoće proizvoda na koji je takva nuspojava prijavljena.
Tablica 9. Vrste prijavljenih nuspojava u 2012. godini uz usporedbu s prijavljenim nuspojavama u 2008., 2009., 2010. i 2011. godini
| Vrsta nuspojava | 2012. | 2011. | 2010. | 2009. | 2008. |
|---|---|---|---|---|---|
| Tip A | 4386 (84%) | 3810 (80%) | 2432 (84%) | 1981 (84%) | 1801 (81%) |
| Tip B | 718 (14%) | 781 (16%) | 439 (15%) | 358 (15%) | 395 (18%) |
| Tip F | 94 (2%) | 178 (4%) | 16 (1%) | 16 (1%) | 16 (1%) |
| UKUPNO: | 5198 | 4769 | 2887 | 2355 | 2212 |
Tablica 10. Odnos spola i reakcija tipa B u 2012. godini
| Spol | Broj nuspojava tipa B | % |
|---|---|---|
| Muškarci | 216 | 30 |
| Žene | 482 | 67 |
| Nepoznato | 20 | 3 |
| UKUPNO: | 718 | 100 |
Slika 16. Udio nuspojava tipa B po spolu bolesnika/korisnika lijekova u razdoblju od 2005. do 2012. godine
1.2.4. Broj lijekova u istovremenoj primjeni
Što se tiče odnosa dobi bolesnika i broja lijekova koje bolesnik istovremeno primjenjuje, u 2012. godini nije bilo većih promjena kod mlađih dobnih skupina, čija zastupljenost u ukupnom broju lijekova u istovremenoj primjeni pada iz godine u godinu, prvenstveno zbog manjeg broja prijava sumnji na nuspojave cjepiva. Najveći pomaci mogu se primijetiti u starijim dobnim skupinama (41-64, 75-84), u kojima je uočljiv porast broja lijekova u istovremenoj primjeni u odnosu na ranije godine. Uzimanjem više lijekova istovremeno eksponencijalno se povećava mogućnost interakcije između brojnih lijekova, a time i mogućnost pojave nuspojava koje su posljedica interakcija (Tablica 11.).
Tablica 11. Dob bolesnika i broj lijekova koje bolesnik istodobno primjenjuje
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | Ukupan broj bolesnika po dobnoj kategoriji |
|---|---|---|---|---|---|
| Do 12 mjeseci | 13 | 2 | 1 | 0 | 16 |
| 1-2 godine | 20 | 2 | 0 | 0 | 22 |
| 3-6 godina | 25 | 9 | 2 | 0 | 36 |
| 7-14 godina | 61 | 8 | 2 | 0 | 71 |
| 15-17 godina | 7 | 9 | 1 | 0 | 17 |
| 18-40 godina | 164 | 117 | 41 | 14 | 336 |
| 41-64 godine | 229 | 233 | 126 | 59 | 647 |
| 65-74 godina | 66 | 90 | 103 | 55 | 314 |
| 75-84 godina | 35 | 45 | 58 | 32 | 170 |
| > 85 godina | 3 | 11 | 6 | 5 | 25 |
| Neupisano | 133 | 74 | 38 | 24 | 269 |
| Broj bolesnika prema istodobno primijenjenim lijekovima | 756 | 600 | 378 | 189 | 1923 |
U 2012. godini broj nuspojava koje ne ispunjavaju niti jedan od kriterija za ozbiljnu nuspojavu značajno je veći od broja onih koji takve kriterije ispunjavaju. Nuspojave koje zadovoljavaju najmanje jedan od navedenih kriterija smatraju se u regulatornom smislu ozbiljnima:
- ako se radi o medicinski značajnom stanju koje se može smatrati ozbiljnim
- ako je nuspojava uzrokovala hospitalizaciju (bolničko liječenje) ili produženje hospitalizacije
- ako je došlo do razvoja anomalije kod novorođenčeta zbog toga što je majka uzimala lijek tijekom trudnoće
- ako je nuspojava izazvala invalidnost ili trajnu nesposobnost
- ako nuspojava ugrožava život bolesnika/korisnika lijeka
- ako je nuspojava izazvala smrt osobe.
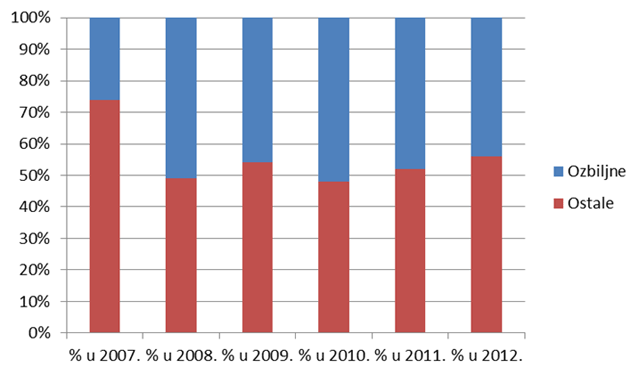
Razlozi za pad udjela ozbiljnih nuspojava među prijavljenim nuspojavama mogu se pronaći u sve većem broju prijava od strane farmaceuta, kao i manjem broju prijava iz bolničkih ustanova.
Slika 17. Udio ozbiljnih nuspojava za razdoblje od 2007. do 2012. godine
Tablica 12. Ozbiljne nuspojave prijavljene u 2012. godini - kriteriji prema ICH smjernici E2A u usporedbi s 2007., 2008., 2009., 2010. i 2011. godinom
| Kriterij | Broj prijava u 2012. | % u 2012. | % u 2011. | % u 2010. | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|---|---|
| Smrt | 36 | 4 | 1 | 3 | 2 | 4 | 4 |
| Hospitalizacija | 302 | 30 | 21 | 23 | 20 | 20 | 41 |
| Invalidnost | 35 | 4 | 0 | 0 | 0 | 0 | 0 |
| Ugrožava život | 72 | 7 | 5 | 6 | 4,5 | 5,1 | 14 |
| Prirođena anomalija | 2 | 0 | 0 | 1 | 0,5 | 0 | 0 |
| Medicinski značajno ozbiljno stanje | 560 | 55 | 73 | 66 | 73 | 71 | 37 |
| UKUPNO: | 1007* | 100 | 100 | 100 | 100 | 100 | 100 |
*neke nuspojave ispunjavaju nekoliko kriterija ozbiljnosti pa je ukupan zbroj u Tablici 13. veći od ukupnog broja prijava ozbiljnih nuspojava
U 2012. godini zabilježen je veći broj prijava s poznatim ishodom nuspojava. Posebno je dobro što je porastao broj ishoda bez posljedica za bolesnike koji su doživjeli nuspojavu (Tablica 13). HALMED će putem dodatnih edukativnih aktivnosti pokušati dodatno poboljšati ovaj pokazatelj kvalitete prijava.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u 36 slučajeva. Od navedenih 36 prijava, u dva je slučaja bila riječ o suicidu; u dva slučaja o slučajnom trovanju lijekom, a u jednome slučaju o reakciji preosjetljivosti (kakve je nemoguće predvidjeti) s, nažalost, najtežim ishodom. U 19 je slučajeva nuspojava označena kao moguće doprinoseća smrtnom ishodu, u sedam je slučajeva ocijenjeno kako ta povezanost nije vjerojatna, dok je u pet slučajeva nuspojava označena kao nepovezana sa smrtnim ishodom. Važno je naglasiti kako se u najvećem broju smrtnih slučajeva za koje se sumnja da su povezani s lijekovima radi o bolesnicima s teškom osnovnom bolešću (npr. multipli mijelom, kolorektalni karcinom, rak dojke itd.), što dodatno otežava procjenu povezanosti lijeka i nuspojave sa smrtnim ishodom.
Tablica 13. Broj prijava i udio ishoda po prijavama nuspojava lijekova i cjepiva u 2012. godini u usporedbi s udjelom u 2011., 2010., 2009. i 2008. godini
| Ishod nuspojave | 2012. (broj prijava) | % u 2012. | % u 2011. | % u 2010. | % u 2009. | % u 2008. |
|---|---|---|---|---|---|---|
| Oporavak bez posljedica | 2772 | 57 | 52 | 53 | 59 | 54,2 |
| Oporavak s posljedicama | 107 | 2 | 1 | 1 | 0,5 | 0,3 |
| U tijeku | 401 | 8 | 4 | 9 | 5,5 | 20 |
| Bez oporavka/Nepoznato | 1544 | 32 | 42 | 35 | 34 | 23,5 |
1.2.7. Nuspojave po organskim sustavima
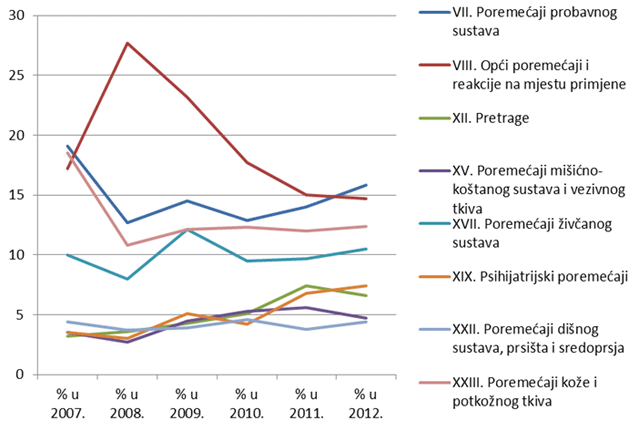
Nuspojave su navedene prema MedDRA-inoj klasifikaciji organskih sustava (MedDRA - Medical Dictionary for Regulatory Activities, odnosno Medicinski rječnik za regulatorne poslove), koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom polju. U 2012. godini najveći broj nuspojava zabilježen je za SOC-eve kao i prošlih godina: najviše je nuspojava iz SOC-a Poremećaji probavnog sustava (15,8% prema 14% iz 2011), Opći poremećaji i reakcije na mjestu primjene (14,7 prema 15% iz 2011.) Slijede Poremećaji kože i potkožnog tkiva s udjelom od 12,4% te Poremećaji živčanog sustava sa 10,5% ukupnog broja nuspojava. HALMED je u 2012. godini zabilježio 18 nuspojava iz SOC-a Dobroćudne, zloćudne i nespecificirane novotvorine te 2 nuspojave iz SOC-a Prirođeni, obiteljski i genetski poremećaji (Tablica 14).
HALMED smatra da je potrebno i dalje veliku pozornost posvetiti nuspojavama iz područja genetskih poremećaja i malformacija zbog njihova značaja za sigurnost primjene lijekova u trudnoći i slijedom toga radit će se na educiranju i informiranju zdravstvenih radnika i pacijenata.
Tablica 14. Nuspojave po MedDRA-inoj klasifikaciji organskih sustava u 2012. godini - ukupni broj i udio prijava prema organskim sustavima
| Organski sustav (SOC) | Broj nuspojava u 2012. | Udio nuspojava u 2012. (%) |
|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 184 | 3,5 |
| II. Srčani poremećaji | 103 | 2 |
| III. Prirođeni, obiteljski i genetski poremećaji | 2 | 0,1 |
| IV. Poremećaji uha i labirinta | 59 | 1,1 |
| V. Endokrini poremećaji | 17 | 0,3 |
| VI. Poremećaji oka | 139 | 2,7 |
| VII. Poremećaji probavnog sustava | 824 | 15,8 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 764 | 14,7 |
| IX. Poremećaji jetre i žuči | 34 | 0,7 |
| X. Poremećaji imunološkog sustava | 54 | 1 |
| XI. Infekcije i infestacije | 90 | 1,7 |
| XII. Pretrage | 343 | 6,6 |
| XII. Ozljede, trovanja i proceduralne komplikacije | 116 | 2,2 |
| XIV. Poremećaji metabolizma i prehrane | 86 | 1,7 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 246 | 4,7 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 18 | 0,5 |
| XVII. Poremećaji živčanog sustava | 547 | 10,5 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 23 | 0,4 |
| XIX. Psihijatrijski poremećaji | 385 | 7,4 |
| XX. Poremećaji bubrega i mokraćnog sustava | 61 | 1,2 |
| XXI. Poremećaji reproduktivnog sustava i dojki | 93 | 1,8 |
| XXII. Poremećaji dišnog sustava, prsišta i sredoprsja | 227 | 4,4 |
| XXIII. Poremećaji kože i potkožnog tkiva | 645 | 12,4 |
| XXIV. Socijalne okolnosti | 41 | 0,8 |
| XXV. Operativni i medicinski postupci | 18 | 0,3 |
| XXVI. Krvožilni poremećaji | 79 | 1,5 |
| UKUPNO: | 5198 | 100 |
Slika 18. Prikaz kretanja nuspojava iz najzastupljenijih organskih sustava u razdoblju od 2007. do 2012. godine
1.2.8. Najčešće prijavljene nuspojave u 2012. godini
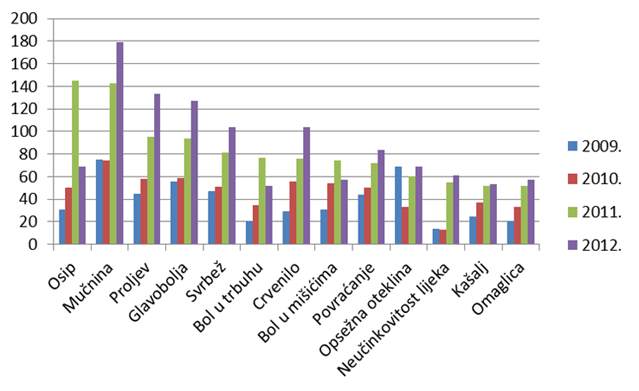
Kao i u prošlogodišnjem izvješću, donosimo pregled najčešće prijavljenih nuspojava. Navedene su samo one nuspojave koje su prijavljene više od 50 puta. U usporedbi s 2011. godinom, iste nuspojave zauzimaju prvih desetak mjesta s nešto promijenjenim udjelom u ukupnom broju nuspojava. U 2012. godini veći udio čine nuspojave kao što su mučnina, proljev, povraćanje, što su nuspojave koje su karakteristične za klasične sintetske lijekove. Pretpostavlja se da se u praksi dio simptoma ne prepozna kao nuspojava lijekova već se dijagnosticira "nova bolest" (hipertenzija, kardiovaskularni incidenti, prijelom kostiju, razvoj depresije).
Tablica 15. Najčešće prijavljene nuspojave u 2012. godini u usporedbi s prijavama iz 2011. godine
| Nuspojava | Broj prijava u 2012. godini | Broj prijava u 2011. godini |
|---|---|---|
| Mučnina | 179 | 143 |
| Proljev | 133 | 95 |
| Glavobolja | 127 | 94 |
| Svrbež | 104 | 81 |
| Crvenilo | 104 | 76 |
| Povraćanje | 84 | 72 |
| Osip | 69 | 145 |
| Otekline okrajina | 69 | 60 |
| Vrućica | 64 | 64 |
| Urtikarija | 63 | 49 |
| Neučinkovitost lijeka | 61 | 55 |
| Bol u mišićima | 57 | 74 |
| Vrtoglavica | 57 | 52 |
| Kašalj | 53 | 52 |
| Bol u trbuhu | 52 | 77 |
Slika 19. Grafički prikaz najčešće prijavljenih nuspojava u 2012. godini u odnosu na 2011. i 2010. godinu
2. Prijave nuspojava od strane pacijenata/korisnika lijeka
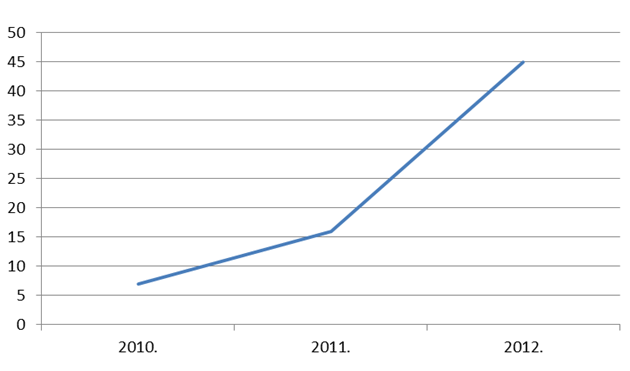
U 2012. godini zaprimili smo 45 prijava na nuspojave lijekova od strane pacijenta/korisnika lijeka. Taj broj je značajno porastao u odnosu na 2010. godinu, kada ih je bilo zaprimljeno samo 7, odnosno na 2011. godinu kada je zaprimljeno ukupno 16 prijava. Porast broja prijava od strane pacijenata se svakako može objasniti i činjenicom da je 17. kolovoza. 2012. godine Agencija za lijekove i medicinske proizvode (HALMED) počela koristiti aplikaciju Uppsala Monitoring Centra, suradnog centra Svjetske zdravstvene organizacije, koja omogućuje pacijentima prijavljivanje sumnji na nuspojave putem internetske stranice HALMED-a. HALMED je jedna od prvih organizacija u svijetu koja je imala priliku testirati i implementirati navedeni sustav. Na ovaj način pacijentima je omogućeno aktivno i jednostavno sudjelovanje u praćenju sigurnosti primjene lijekova.
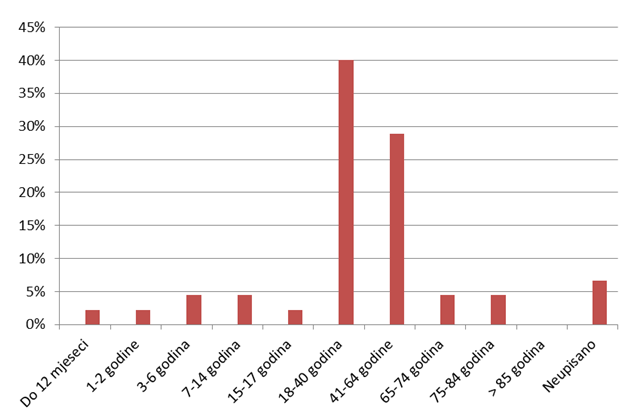
Od ukupno 45 prijava nuspojava, 60% (27) ih je ocijenjeno ozbiljnim, a 40% (18) je ocijenjeno ozbiljnim i neočekivanim nuspojavama. S obzirom na spol, zastupljenije su prijave za žene (60%), dok su prema dobi najzastupljenije dobne skupine od 18-65 godina (Slika 20.).
Slika 20. Prijavljene nuspojave od strane pacijenata prema dobnim skupinama pacijenata
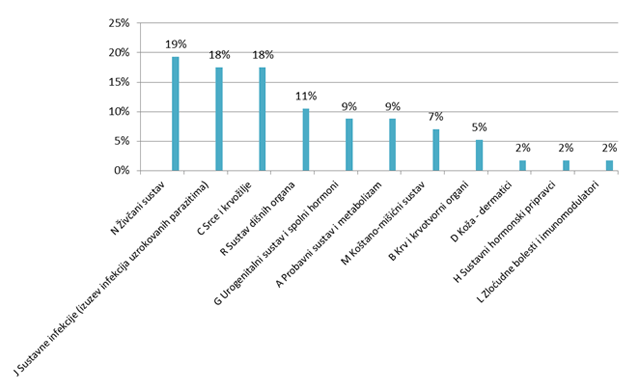
Najviše nuspojava prijavljeno je za lijekove iz skupine N (Pripravci s učinkom na živčani sustav), te za lijekove iz skupine J (Pripravci za liječenje sustavnih infekcija) i C (Pripravci s učinkom na srce i krvožilje), što je sukladno zastupljenosti lijekova i u prijavama od strane zdravstvenih djelatnika (Slika 21.).
Slika 21. Zastupljenost lijekova prema ATK klasifikaciji u prijavama nuspojava od strane pacijenata
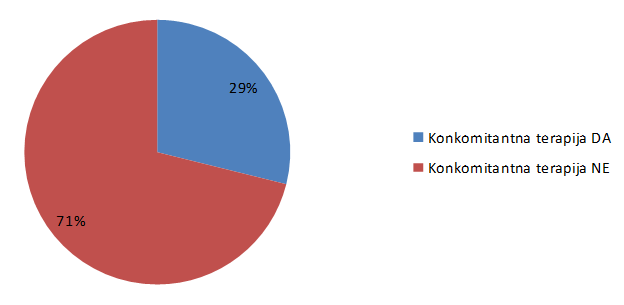
Ukupno 29% pacijenata je u prijavi sumnje na nuspojavu navelo i lijekove u istodobnoj primjeni sa suspektnim lijekom (Slika 22.), što govori o dobroj kvaliteti prijava od strane pacijenata.
Slika 22. Postotak prijava s navedenim lijekovima u istodobnoj primjeni
U prijavama pacijenata najčešće prijavljena nuspojava u 2012. godini bila je glavobolja (3%), a uslijedili su mučnina, proljev, omaglica i osip (2%). Navedene nuspojave su među najčešće prijavljivanima i u prijavama od strane zdravstvenih djelatnika.
Kako je ranije naglašeno, primjetan je značajan skok u broju prijava nuspojava od strane pacijenata u 2012. godini (Slika 23.). Međutim, uzevši u obzir ukupan broj prijavljenih nuspojava u 2012. godini, udio prijava od pacijenata je još uvijek nizak. Stoga je potrebno stalno raditi na osvještavanju pacijenata o važnosti prijavljivanja nuspojava na lijekove kako bi se ovaj pozitivan trend rasta prijava nastavio.
Slika 23. Kretanje broja prijavljenih nuspojava od strane pacijenata u razdoblju od 2010. do 2012. godine
3. Pregled sigurnosnih pitanja u 2012. godini
3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2012. godini
HALMED je uveo nove kontraindikacije i upozorenja u Sažetke opisa svojstava lijeka i Upute o lijeku za lijekove koji sadrže aliskiren (Rasilez i Rasilez HCT tablete) kako bi se smanjio rizik od kardiovaskularnih i renalnih nuspojava zbog interakcije s određenim drugim antihipertenzivnim lijekovima. O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Lijekovi koji sadrže aliskiren odobreni su za liječenje esencijalne hipertenzije (povišenog krvnog tlaka bez poznatog očitog uzroka).
Zbog rizika od kardiovaskularnih i renalnih nuspojava, u bolesnika sa šećernom bolešću ili oštećenjem bubrega kontraindicirana je istodobna primjena lijekova koji sadrže aliskiren s antihipertenzivima iz skupine inhibitora angiotenzin konvertirajućeg enzima (ACE) ili blokatora angiotenzinskih receptora (ARB), dok se u svih drugih bolesnika takva primjena ne preporučuje.
Nove kontraindikacije i upozorenja za lijekove koji sadrže aliskiren rezultat su ocjene kliničkog ispitivanja aliskirena u bolesnika s dijabetesom tipa 2 i visokim rizikom od kardiovaskularnih i renalnih događaja. U navedenom ispitivanju otkrivena je veća incidencija štetnih događaja povezanih s nesmrtonosnim moždanim udarom, bubrežnim komplikacijama, hiperkalemijom i hipotenzijom zbog čega je još u prosincu 2011. godine upućeno pismo zdravstvenim radnicima s privremenim preporukama za liječenje.
HALMED je uveo nova upozorenja u Sažetak opisa svojstava lijeka i Uputu o lijeku za lijek Victrelis (boceprevir) zbog rizika od interakcije s lijekovima za liječenje HIV-a koja može dovesti do smanjenja učinka obaju primijenjenih lijekova. O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Ovaj lijek odobren je za liječenje kronične infekcije virusom hepatitisa C, u kombinaciji s drugim lijekovima, u odraslih bolesnika s kompenziranom bolešću jetre koji prethodno nisu bili liječeni ili nisu uspješno odgovorili na prethodno liječenje.
Upozorenja se odnose na nova saznanja o interakcijama boceprevira s inhibitorima HIV proteaze pojačanim ritonavirom, koji se koriste u liječenju bolesnika inficiranih virusom humane imunodeficijencije (HIV-1). Interakcija ovih lijekova dovodi do sniženja njihovih razina u krvi, što može značiti smanjenje njihove učinkovitosti kod bolesnika koji su zaraženi i HIV-om i HCV-om.
Podaci o navedenim interakcijama dobiveni su iz ispitivanja na zdravim dobrovoljcima, a sniženje razine u krvi različito je za različite inhibitore HIV proteaze. Zbog toga se istodobna primjena boceprevira s kombinacijom darunavira ili lopinavira s ritonavirom ne preporučuje, dok se istodobna primjena boceprevira s kombinacijom atazanavira i ritonavira može razmotriti u pojedinačnim slučajevima ako se smatra neophodnom, a zahtijeva pojačan klinički i laboratorijski nadzor radi praćenja supresije HIV-a.
HALMED je izmijenio preporuke za doziranje i primjenu u Sažetku opisa svojstava lijeka i Uputi o lijeku za lijek Perfalgan (intravenski paracetamol) kako bi se smanjio rizik od slučajnog predoziranja navedenim lijekom. O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Ovaj lijek odobren je za kratkotrajno liječenje umjereno jake boli, osobito nakon operacije, i za kratkotrajno liječenje vrućice kad je primjena intravenskim putem klinički opravdana.
Preporuke za doziranje izmijenjene su i pojašnjene zbog rizika od slučajnog predoziranja ovim lijekom, što je osobito značajno u novorođenčadi i dojenčadi te u bolesnika tjelesne težine ≤50 kg.
Jačina lijeka Perfalgan 10 mg/ml je 10 miligrama paracetamola na 1 mililitar otopine. Do pogreške u doziranju lijeka može doći ako se doza lijeka koju je potrebno primijeniti izračuna u miligramima, a lijek se primijeni u mililitrima. Rezultat ove pogreške jest primjena doza 10 puta viših od one koju je potrebno primijeniti. Kako bi se izbjegla pogreška u doziranju u novorođenčadi i dojenčadi te zabuna između miligrama (mg) i mililitra (ml), preporučuje se specificirati namijenjeni volumen za primjenu u mililitrima (ml).
HALMED je uveo nove kontraindikacije i revidirana upozorenja u Sažetak opisa svojstava lijeka i Uputu o lijeku za lijekove koji sadrže stroncijev ranelat (Osseor i Protelos tablete) kako bi se smanjio rizik od nastanka venske tromboembolije i teških kožnih reakcija. O novim informacijama upućeno je pismo zdravstvenim radnicima, a HALMED je informirao javnost putem svojih internetskih stranica.
Ovaj lijek odobren je za liječenje žena u postmenopauzi s ciljem smanjenja rizika od prijeloma kralježnice i kukova te za liječenje osteoporoze u muškaraca s povećanim rizikom od prijeloma.
Rizici od nastanka venske tromboembolije i teških kožnih reakcija, koje uključuju Stevens-Johnsonov sindrom (SJS), toksičnu epidermalnu nekrolizu (TEN) i osip uzrokovan lijekom uz eozinofiliju i sustavne simptome (DRESS), od ranije su poznati za stroncijev ranelat. Kako bi se bolje upravljalo ovim rizicima, uvedena je kontraindikacija u bolesnika koji boluju ili su bolovali od venske tromboembolije, kao i kod bolesnika s privremenom ili trajnom imobilizacijom. S obzirom da se najbolji rezultati u liječenju teških kožnih reakcija pokazuju kod ranog otkrivanja i trenutnog prekida uzimanja suspektnog lijeka, revidirana su upozorenja o tim reakcijama kako bi i propisivači i bolesnici upućeni i upozoreni na moguće vrijeme nastanka kao i znakove i simptome ovih reakcija.
Nove kontraindikacije i revidirana upozorenja uvrštene su zato što venska tromboembolija i teške kožne reakcije čine većinu ozbiljnih nuspojava prijavljenih za stroncijev ranelat. O riziku od DRESS-a uz primjenu stroncijevog ranelata je pod nadzorom HALMED-a je još 2007. bilo upućeno pismo zdravstvenim radnicima.
HALMED je iz preventivnih razloga skratio rok valjanosti lijeka Athyrazol, čija je djelatna tvar tiamazol, s pet na jednu godinu i ta je informacija uvrštena u Sažetak opisa svojstava lijeka i u pakovanje lijeka. O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Ovaj lijek odobren je za liječenje hipertireoze pri Gravesovoj bolesti, prije kirurškog zahvata na štitnoj žlijezdi, liječenja zračenjem ili jodom u bolesnika s hipertireozom.
Odluka o skraćenju roka valjanosti donesena je nakon što je provedeno ispitivanje stabilnosti pokazalo prisutnost većeg sadržaja razgradnih produkata djelatne tvari u odnosu na specifikaciju lijeka. Zbog navedenog je provedena toksikološka evaluacija i procjena rizika za pacijente, na temelju čega je zaključeno da sadržaj navedenih razgradnih produkata ne predstavlja toksikološki rizik za pacijente. Zbog većeg sadržaja razgradnih produkata je ipak, iz preventivnih razloga, ovom lijeku skraćen rok valjanosti.
HALMED je uveo nova ograničenja u doziranju i upozorenja za primjenu ondanzetrona kod njegove intravenske primjene za prevenciju mučnine i povraćanja uzrokovanih kemoterapijom kako bi se smanjio rizik od produljenja QT intervala. Ova upozorenja uvrštena su u Sažetak opisa svojstava lijeka i Uputu o lijeku za sve lijekove odobrene u Republici Hrvatskoj za intravensku primjenu čija je djelatna tvar ondanzetron (Zofran, Setronon i Ondanzetron Kabi). O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Ondanzetron je u intravenskom obliku odobren za liječenje mučnine i povraćanja uzrokovanih citotoksičnom kemoterapijom i radioterapijom te u prevenciji i liječenju postoperativne mučnine i povraćanja.
Rizik od produljenja QT intervala od ranije je poznat za ovaj lijek, međutim, do sada nije bio poznat stupanj produljenja QT intervala. Novo ograničenje odnosi se na pojedinačnu dozu intravenski primijenjenog ondanzetrona za prevenciju mučnine i povraćanja uzrokovanog kemoterapijom koja kod odraslih ne smije preći 16 mg (primijenjeno tijekom najmanje 15 minuta). Ovo ograničenje proizašlo je iz rezultata nedavno završene kliničke studije, u kojoj je ondanzetron uspoređivan s placebom i moksifloksacinom, a koji su pokazali da ondanzetron dovodi do produljenja QT intervala koje je povezano s dozom.
HALMED je ograničio indikaciju te uveo nove kontraindikacije i upozorenja u Sažetak opisa svojstava lijeka i Uputu o lijeku za lijekove koji sadrže trimetazidin (Preductal MR, Trimepect, Trimetazidin PharmaS i Vazidin tablete), kako bi se smanjio rizik od ozbiljnih nuspojava koje se javljaju u obliku ekstrapiramidnih simptoma. O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Prema novoj, ograničenoj indikaciji, trimetazidin se smije primjenjivati u simptomatskom liječenju stabilne angine pektoris u odraslih bolesnika samo kao dodatno liječenje, u bolesnika čiji su simptomi nedostatno kontrolirani lijekovima prvog izbora za liječenje angine ili koji ne podnose takvo liječenje.
Ponovna procjena omjera koristi i rizika primjene trimetazidina inicirana je zbog nuspojava koje se javljaju u obliku ekstrapiramidnih simptoma te je zaključeno da se trimetazidin ne smije primjenjivati kod bolesnika s Parkinsonovom bolesti, ekstrapiramidnim simptomima, tremorom, sindromom nemirnih nogu i drugim poremećajima kretanja, a mora se trajno ukinuti u bolesnika u kojih se prilikom liječenja razviju ekstrapiramidni simptomi. Trimetazidin se također ne smije primjenjivati kod bolesnika s teškim oštećenjem bubrega, dok je kod bolesnika s umjerenim oštećenjem bubrega kao i kod starijih bolesnika potrebno smanjiti dozu.
HALMED je uveo kontraindikaciju za intramuskularnu primjenu fitomenadiona (Konakion MM otopina za injekciju) u Sažetak opisa svojstava lijeka i Uputu o lijeku za ovaj lijek kako bi se smanjio rizik od poteškoća pri ponovnom uvođenju antikoagulacijskog liječenja. O novim informacijama upućeno je pismo zdravstvenim radnicima te je HALMED o navedenome informirao javnost putem svojih internetskih stranica.
Ovaj lijek odobren je za liječenje krvarenja ili prijetećih krvarenja povezanih s niskom razinom protrombina ili faktora VII u krvi, a prvenstveno se primjenjuje kao antidot za antikoagulanse kumarinskog tipa.
Kontraindikacija za intramuskularnu primjenu uvedena je zato jer intramuskularna primjena fitomenadiona (vitamina K1) pokazuje svojstva depoa, što znači da pri dugotrajnijem otpuštanju lijeka mogu nastati poteškoće kod ponovnog uvođenja antikoagulacijskog liječenja. Nadalje, intramuskularne injekcije primijenjene u osoba koje primaju antikoagulacijsko liječenje dovode do rizika od nastanka hematoma.
3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2012. godini
3.2.1. Prijave sumnji na neurološke nuspojave cjepiva protiv gripe Fluimun i Focetria
HALMED je u razdoblju od srpnja do rujna 2012. godine zaprimio ukupno pet prijava sumnji na neurološke nuspojave cjepiva protiv gripe. S ciljem ocjene prijavljenih sumnji na nuspojave i ocjene utječu li navedene prijave na omjer koristi i rizika primijenjenih cjepiva, HALMED je osnovao stručno Povjerenstvo za ocjenu prijava sumnji na nuspojave cjepiva protiv gripe. Povjerenstvo je ocijenilo ukupno pet prijava sumnji na neurološke nuspojave za koje je HALMED-u bila dostavljena medicinska dokumentacija, od kojih je za dvije HALMED saznao putem medija, a tri su bile naknadno prijavljene direktno od pacijenata.
U svih pet slučajeva radilo se o prijavama sumnji na nuspojavu Guillain-Barréov sindrom (GBS). GBS je autoimuni poremećaj koji se klinički manifestira kao upalna poliradikuloneuropatija s posljedičnom simetričnom (obostranom) mišićnom slabošću i oslabljenim refleksima u zahvaćenim područjima. Uzrok GBS-a zasad nije poznat, no brojna epidemiološka istraživanja provedena tijekom posljednjih 30-tak godina jasno ukazuju da su najvažniji pojedinačni čimbenici rizika za razvoj GBS-a: prehlada i druge infekcije gornjeg dišnog sustava, gripa (sezonska ili bilo koji drugi oblik) i sindromi nalik gripi te pojedine infekcije probavnog sustava. Osobe koje obole od tih bolesti imaju 5-10 puta veći rizik da u sljedećih šest do osam tjedana obole od GBS-a. GBS je poznata i očekivana nuspojava na cjepiva koja se događa vrlo rijetko, odnosno kod manje od jedne na 10.000 cijepljenih osoba.
U analizi pojedinačnih prijava sumnji na nuspojave na cjepiva protiv gripe u Republici Hrvatskoj, cilj HALMED-ovog Povjerenstva je bio točno identificirati o kojim se cjepivima radi i postoji li na individualnoj razini povezanost prijavljenih nuspojava i primijenjenih cjepiva. Utvrđeno je da je svih pet pacijenata primilo cjepivo protiv sezonske gripe (Fluimun), dok je jedan pacijent, uz cjepivo protiv sezonske gripe, primio i cjepivo protiv pandemijske gripe (Focetria). Povjerenstvo je kod jednog od pet navedenih pacijenata ocijenilo da prijavljeni simptomi odgovaraju definiciji GBS-a, povezanost prijavljenih simptoma s primijenjenim sezonskim cjepivom ocijenjena je mogućom, ali se nisu mogli isključiti drugi mogući uzroci prijavljenih simptoma. Kod drugog pacijenta, Povjerenstvo je zaključilo da prijavljeni simptomi ne odgovaraju definiciji GBS-a, ali je njihova povezanost s cjepivom ocijenjena mogućom, dok je kod trećeg pacijenata ocijenjeno da prijavljeni simptomi odgovaraju definiciji GBS-a, ali povezanost s cjepivom nije ocijenjena vjerojatnom. Kod preostala dva pacijenta, Povjerenstvo je zaključilo da prijavljeni simptomi ne odgovaraju definiciji GBS-a i da nisu povezani s cjepivom protiv gripe.
Nakon detaljne ocjene pojedinačnih prijava sumnji na nuspojave i sveobuhvatne analize farmakoepidemioloških podataka, Povjerenstvo je ocijenilo da omjer koristi i rizika primjene cjepiva protiv gripe ostaje pozitivan, odnosno da navedene prijave ne utječu negativno na omjer koristi i rizika primjene pandemijskog i sezonskog cjepiva protiv gripe.
O rezultatima ocjene prijavljenih sumnji na nuspojave i ocjene omjera koristi i rizika primijenjenih cjepiva koje je provelo stručno Povjerenstvo, HALMED je informirao javnost putem konferencije za novinare i priopćenja za javnost početkom listopada 2012. godine.
3.2.2. Početak ponovne proizvodnje otopina za peritonejsku dijalizu Dianeal, Extraneal i Nutrineal u tvornici u Castlebaru u Irskoj
U veljači 2013. godine upućeno je pismo zdravstvenim radnicima o početku ponovne proizvodnje i distribucije otopina za peritonejsku dijalizu Dianeal, Extraneal i Nutrineal proizvođača Baxter.
Navedene otopine za peritonejsku dijalizu bile su pod pojačanim nadzorom HALMED-a od kraja 2010. godine, kada je ustanovljeno da neke vrećice serija navedenih otopina proizvedenih u tvornici u Castlebaru u Irskoj sadrže povišene razine endotoksina, koji mogu dovesti do upale potrbušnice (aseptički peritonitis) u pojedinih bolesnika. Neke od tih serija bile su distribuirane i u Republici Hrvatskoj.
Iz preventivnih razloga sve potencijalno zahvaćene serije otopina za peritonejsku dijalizu su početkom 2011. godine bile postupno povučene s tržišta Republike Hrvatske uvođenjem zamjenskih serija kojima su bile zadovoljene potrebe tržišta jer bi naglo povlačenje otopina dovelo u pitanje život dijaliziranih bolesnika. Tijekom perioda intenzivnog praćenja nuspojava navedenih otopina za peritonejsku dijalizu broj zabilježenih nuspojava aseptičkog peritonitisa niti u jednom trenutku nije bio viši nego što je očekivani broj pri primjeni peritonejskih otopina.
Nakon niza korektivnih i preventivnih mjera, u siječnju 2012. godine ponovno je započela proizvodnja i distribucija navedenih otopina za peritonejsku dijalizu proizvedenih u tvornici Castlebar u Irskoj.
3.2.3. Kontinuirani nadzor HALMED-a nad sigurnošću primjene lijekova iz uvoza
Tijekom 2012. godine HALMED je nastavio rad u području nadzora nad sigurnošću primjene lijekova koji nisu odobreni u Republici Hrvatskoj, a koji su hrvatskim pacijentima dostupni putem postupka interventnog uvoza. U sklopu navedenih aktivnosti HALMED je tijekom ove godine putem svojih internetskih stranica uputio preporuke zdravstvenim radnicima o primjeni oralnih oblika metotreksata i lijekova čija je djelatna tvar zonisamid.
HALMED je zdravstvenim radnicima koji propisuju metotreksat za oralnu primjenu uputio poziv na oprez prilikom određivanja doze lijeka kako bi se izbjegao rizik od predoziranja ovim lijekom.
Metotreksat je lijek iz skupine antimetabolita čiji se oralni oblici, između ostaloga, primjenjuju u liječenju psorijaze i reumatoidnog artritisa. Doziranje lijeka u navedenim indikacijama treba biti jednom tjedno, a do nenamjernog predoziranja dolazi ako se jednokratna tjedna doza pogreškom primjenjuje kao dnevna doza. Također, HALMED je pozvao zdravstvene radnike da savjetuju bolesnike o pravilnoj primjeni metotreksata za oralnu primjenu kako bi se izbjegao rizik dnevne primjene tjedne doze lijeka.
HALMED je o ovom problemu već 2009. godine uputio pismo zdravstvenim radnicima, a poziv propisivačima na oprez prilikom propisivanja ovog lijeka ponovljen je 2012. godine, nakon što su postali dostupni podaci o tome da je prethodnih godina u Europskoj uniji bilo prijavljenih slučajeva predoziranja zbog dnevne primjene tjedne doze metotreksata. U prijavljenim su se slučajevima javile ozbiljne nuspojave, koje su u nekim slučajevima bile fatalne, osobito zbog hematološke toksičnosti ovog lijeka.
HALMED je zdravstvenim radnicima koji propisuju zonisamid uputio preporuke o indikacijama, kontraindikacijama i upozorenjima vezanim uz primjenu ovog lijeka.
Zonisamid je antiepileptik iz skupine sulfonamida, koji u nekih bolesnika može dovesti do potencijalno fatalnih reakcija preosjetljivosti i idiosinkrazije (ovo uključuje Stevens-Johnsonov sindrom, toksičnu epidermalnu nekrolizu, fulminantnu nekrozu jetre, agranulocitozu, aplastičnu anemiju i druge krvne diskrazije), oligohidroze praćene hipertermijom te metaboličke acidoze s posljedičnim neželjenim učincima na bubrege i kosti.
HALMED je zdravstvene radnike informirao o tome da je zonisamid odobren za liječenje odraslih bolesnika s parcijalnim napadajima, sa ili bez sekundarne generalizacije, kontraindiciran u bolesnika preosjetljivih na zonisamid ili sulfonamide te da je bolesnike liječene ovim lijekom potrebno pozorno pratiti zbog pojave znakova smanjenog znojenja i porasta tjelesne temperature i zbog rizika od metaboličke acidoze.
3.2.4. Rad HALMED-a na poticanju prijava nuspojava od strane pacijenata
HALMED je u kolovozu 2012. godine prvi u svijetu započeo s korištenjem on-line aplikacije za prijavu nuspojava od strane pacijenata koju je razvio Uppsala Monitoring Centre, suradni centar Svjetske zdravstvene organizacije koji vodi Svjetsku bazu nuspojava. Aplikacija UMC-a kojom se pacijentima omogućuje aktivno i jednostavno sudjelovanje u praćenju sigurnosti primjene lijekova dostupna je na internetskim stranicama HALMED-a, u dijelu Za pacijente/On-line prijava sumnje na nuspojavu.
Putem medija i svojih internetskih stranica HALMED je uputio poziv svim korisnicima lijeka da prijave sumnju na nuspojavu lijeka. Prijavitelj može prijaviti nuspojavu koja se dogodila njemu osobno, njegovom djetetu ili osobama o kojima prijavitelj skrbi, primjerice majci ili supružniku. Osobni podaci koje sadrže prijave nuspojava strogo su povjerljivi i koriste se jedino u svrhu utvrđivanja sigurnosti primjene lijekova. Osobni podaci ne prosljeđuju se trećim osobama bez izričitog odobrenja pacijenta/prijavitelja.
Prijave od strane pacijenata osobito su vrijedne jer pacijenti ponekad mogu prijaviti nuspojave ranije nego zdravstveni radnici, a njihove prijave obično sadržavaju detaljniji opis nuspojava. Porast broja prijava sumnji na nuspojavu lijeka koje je HALMED od pacijenata/korisnika lijeka zaprimio nakon početka primjene navedene on-line aplikacije pokazuje da su pacijenti prepoznali svoju ulogu i značaj u prijavljivanju nuspojava.
Osim kroz početak korištenja on-line aplikacije za prijavu nuspojava, HALMED je s ciljem poticanja prijavljivanja nuspojava od strane pacijenata tijekom 2012. godine izradio informativni letak pod nazivom "Prijavljivanje nuspojava - Vodič za pacijente". Letak je namijenjen izravnoj distribuciji pacijentima na skupovima bolesničkih udruga pa je tako distribuiran sudionicima 7. Europskih igara transplantiranih i dijaliziranih, održanih u kolovozu 2012. godine u Zagrebu. Letak je dostupan i na internetskim stranicama HALMED-a, putem poveznice Prijavljivanje nuspojava - Vodič za pacijente.





