Izvješće o nuspojavama u 2011. godini
- Uvod
- 1. Prijave nuspojava u 2011. godini
- 1.1. Izvori prijava
- 1.2. Karakteristike prijava nuspojava lijekova i cjepiva
- 1.2.1. Klasifikacija lijekova
- 1.2.2. Dob i spol bolesnika
- 1.2.3. Vrste nuspojava
- 1.2.4. Broj lijekova u istovremenoj primjeni
- 1.2.5. Ozbiljnost nuspojave
- 1.2.6. Ishod nuspojave
- 1.2.7. Nuspojave po organskim sustavima
- 1.2.8. Najčešće prijavljene nuspojave u 2011. godini
- 2. Pregled sigurnosnih regulatornih akcija u 2011. godini
- 2.1. Ketoprofen
- 2.2. Stavudin
- 2.3. Kodein
- 2.4. Pioglitazon
- 2.5. Buflomedil
- 2.6. Citalopram
- 2.7. Escitalopram
- 2.8. Dronedaron
- 2.9. Dasatinib
Uvod
Na temelju Zakona o lijekovima (Narodne novine, br. 71/07., 45/09. i 124/11.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 125/09.) Agencija za lijekove i medicinske proizvode - HALMED (u daljnjem tekstu HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje gotovog lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave nuspojava lijekova od pacijenata. HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je sedmo (7.) izvješće o prijavama nuspojava zaprimljenima iz Republike Hrvatske koje je izradio HALMED.
1. Prijave nuspojava
Tijekom 2011. godine HALMED je zaprimio ukupno 2040 prijava nuspojava u Republici Hrvatskoj.
Ukupan broj prijava nuspojava u 2011. godini u Republici Hrvatskoj čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave nuspojava izravno prijavljene HALMED-u od strane zdravstvenih radnika
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje gotovog lijeka u promet koje su zaprimili od zdravstvenih radnika ili pacijenata
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje gotovog lijeka u promet koje su zaprimili od zdravstvenih radnika ili pacijenata
- spontanih prijava nuspojava cjepiva zaprimljenih u HALMED-u:
-
- prijava nuspojava na cjepiva koje zaprima Hrvatski zavod za javno zdravstvo (HZJZ) i prosljeđuje HALMED-u
- prijava nuspojava cjepiva koje je HALMED izravno primio od zdravstvenih radnika, nositelja odobrenja ili pacijenata
- prijava nuspojava dodataka prehrani
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR-a) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj.
Broj prijava iz svake od ovih skupina prikazan je u Tablici 1, a njihov udio na Slici 1.
Tablica 1. Prijave nuspojava po skupinama proizvoda (ukupan broj)
| Skupine | Lijekovi | Cjepiva | Dodaci prehrani | SUSAR* | UKUPNO |
|---|---|---|---|---|---|
| Broj prijava | 1831 | 191 | 5 | 13 | 2040 |
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Slika 1. Udio prijava nuspojava po skupinama proizvoda
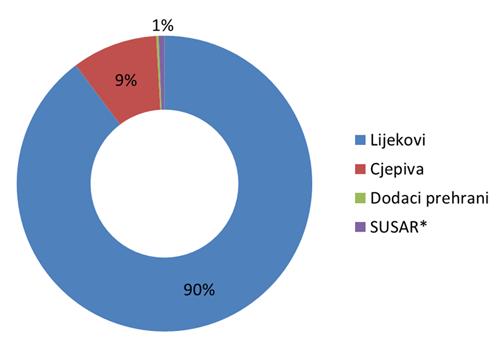
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
U daljnjem tekstu ovog Izvješća analizirane su prijave nuspojava lijekova prikupljene spontanim praćenjem nuspojava od strane zdravstvenih radnika, pacijenata i nositelja odobrenja te prijave nuspojava na cjepiva, dakle izuzete su prijave nuspojave iz područja kliničkih ispitivanja (SUSAR). Tijekom 2011. godine HALMED je zaprimio ukupno 2027 spontanih prijava sumnji na nuspojave u Republici Hrvatskoj.
Od 2027 zaprimljenih spontanih prijava (nuspojave na lijekove, cjepiva i dodatke prehrani), 82 prijave su dobivene iz objavljenih literaturnih podataka o nuspojavama zabilježenima u Republici Hrvatskoj, 94 prijave su iz neintervencijskih postmarketinških studija, dok je 1835 prijava prikupljeno spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika i pacijenata izravno HALMED-u, preko nositelja odobrenja za stavljanje gotovog lijeka u promet ili od Hrvatskog zavoda za javno zdravstvo. Ukupno 16 prijava nuspojava lijekova zaprimljeno je od pacijenata/korisnika lijeka koji su nuspojavu prijavili izravno HALMED-u.
Ključni zaključci razmatranja dobivenih podataka su sljedeći:
- Broj spontanih prijava porastao je za 53% u odnosu na 2010. godinu (2027 prijava prema 1322 u 2010. godini)
- Šezdeset i pet posto (65%) svih prijava sumnji na nuspojave u 2011. godini zaprimljeno je od liječnika
- Udio prijava od strane ljekarnika je porastao za četiri posto u odnosu na 2010. godinu (24% u 2011. godini u odnosu na 20% u 2010. godini)
- Broj prijava od strane pacijenata izravno HALMED-u i dalje je ostao marginalan u 2011. godini (16 prijava, što je ukupni udio od manje od 1% svih prijava)
- Udio prijava dobivenih od nositelja odobrenja za stavljanje lijeka u promet iznosi 33%, što je do sada najveći udio zabilježen u HALMED-ovim izvješćima
- Vrijedi istaknuti i da je po prvi put zabilježen značajni porast prijava sumnji na nuspojave od strane medicinskih sestara (ukupno 44 prijave u 2011. godini u odnosu na ranijih dvije do tri prijave godišnje, što je 22 puta više nego dosadašnjih godina)
- Broj prijava iz bolničkih ustanova u 2011. godini dosegnuo je gotovo trećinu svih prijava (32%), što je najveći broj prijava iz bolničkih ustanova do sada zabilježen od početka prikupljanja prijava od strane HALMED-a.
- U 2011. godini veći je broj prijava bio za nuspojave koje ne udovoljavaju kriterijima ozbiljne nuspojave (52% prema 48%), za razliku od prethodne godine kada je udio prijava ozbiljnih nuspojava bio veći. Posebno treba istaknuti da je, u 2011. godini, usprkos činjenici da je zaprimljeno 53% više prijava nego u 2010. godini, broj prijavljenih sumnji na nuspojavu sa smrtnim ishodom više nego upola manji (10 prijava prema 24 prijave iz 2010. godine).
Nagli porast broja prijava u 2011. godini može se objasniti i većim brojem prijava od strane zdravstvenih radnika (posebno bolničkih) u sklopu HALMED-ovog projekta individualizacije terapije na području nuspojava lijekova u suradnji s Kliničkim bolničkim centrom Zagreb, odnosno sprječavanje nuspojava na temelju farmakogenomske analize.
Važno je naglasiti da opći porast broja prijava ne znači ujedno i problem s kakvoćom, djelotvornošću ili sigurnošću primjene lijekova. Upravo suprotno, veći broj prijava općenito je indikator kvalitete samog sustava prijavljivanja nuspojava te svaka dodatna prijava znači dodatnu informaciju o lijeku za korisnike lijeka i zdravstvene radnike, što u konačnici dovodi do sigurnije primjene lijekova. Signal nastaje tek kad je stopa prijavljivanja za određenu kombinaciju lijek-nuspojava značajno viša od očekivane. Generiranjem signala HALMED takve slučajeve može na vrijeme uočiti i poduzeti sve potrebne regulatorne akcije za zaštitu javnog zdravlja i pojedinaca koji određeni lijek trebaju u svojoj terapiji. Regulatorne akcije uključuju izmjenu doze, indikacije ili načina primjene lijeka, uvođenje novih kontraindikacija i mjera opreza, izmjenu podataka o lijeku i informiranje zdravstvenih radnika, pacijenata i javnosti te, u slučaju potrebe, privremeno ili trajno ukidanje odobrenja za stavljanje lijeka u promet, odnosno povlačenje lijeka s tržišta.
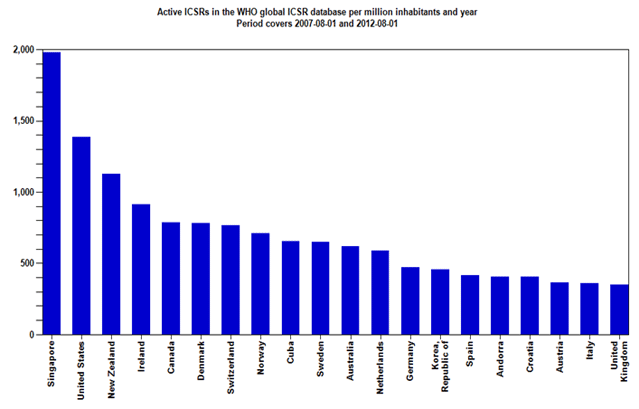
Zahvaljujući zajedničkim naporima HALMED-a i svih zdravstvenih radnika, pacijenata i nositelja odobrenja za lijekove koji redovito prijavljuju sumnje na nuspojave, Republika Hrvatska se, po kvaliteti i broju prijava nuspojava, izraženo na milijun stanovnika, u 2011. godini smjestila na visokom 17. mjestu od 110 zemalja svijeta koje sudjeluju u programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO). Republika Hrvatska je po broju i kvaliteti prijava pretekla čak i Veliku Britaniju - zemlju kolijevku spontanog prijavljivanja nuspojava u svijetu!
Slika 2. preuzeta je sa stranice Uppsala Monitoring Centra (UMC) - centra za praćenje nuspojava Svjetske zdravstvene organizacije (SZO) za razdoblje kolovoz 2007. - kolovoz 2012. godine (http://www.who-umc.org/).
Slika 2. Broj prijava nuspojava na milijun stanovnika u bazi Svjetske zdravstvene organizacije (Uppsala Monitoring Centre - VigiBase), kolovoz 2007. - kolovoz 2012. godine
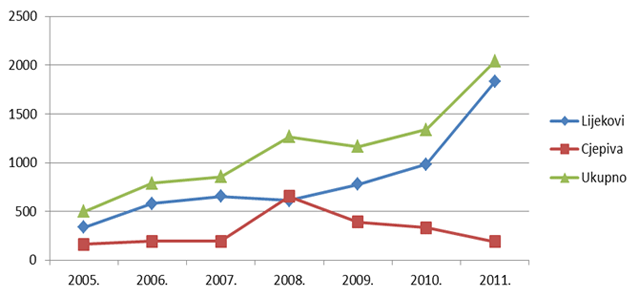
Tablica 2. Kretanje ukupnog broja prijava nuspojava (uključujući SUSAR) u Republici Hrvatskoj u posljednjih sedam godina (2005. - 2011.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. |
|---|---|---|---|---|---|---|---|
| Ukupan broj prijava nuspojava | 498 | 790 | 856 | 1265 | 1165 | 1338 | 2040 |
Tablica 3. Kretanje broja spontanih prijava nuspojava na lijekove i cjepiva u Republici Hrvatskoj u posljednjih sedam godina (2005. - 2011.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. |
|---|---|---|---|---|---|---|---|
| Lijekovi | 336 | 579 | 655 | 611 | 776 | 983 | 1831 |
| Cjepiva | 162 | 194 | 192 | 654 | 389 | 331 | 191 |
Slika 3. Kretanje broja prijava nuspojava u Republici Hrvatskoj u posljednjih sedam godina (2005. - 2011.)
U 2011. godini HALMED je nastavio održavati radionice za zdravstvene radnike i odgovorne osobe za farmakovigilanciju nositelja odobrenja putem kojih ih educira o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj te o načinu i značaju prijavljivanja sumnji na nuspojave. Održano je šest radionica na kojima je sudjelovalo ukupno 54 liječnika, 14 farmaceuta, 113 medicinskih sestara te 4 farmaceutska tehničara, što čini ukupno 185 polaznika. Od rujna 2005. do kraja 2011. godine HALMED je održao ukupno 86 radionica iz područja farmakovigilancije koje je pohađalo i uspješno završilo gotovo 1600 zdravstvenih radnika.
1.1. Izvori prijava
Gotovo dvije trećine prijava sumnji na nuspojave lijekova HALMED-u su u 2011. godini uputili liječnici; nije bilo izrazite prednosti liječnika specijalista nad onima bez specijalizacije - oba izvora sudjelovala su u ukupnom prijavljivanju s gotovo jednakim brojem prijava. Broj prijava od strane ljekarnika porastao je u 2011. godini, u kojoj je zaprimljena 491 prijava iz tog izvora, što čini malo više od 24% svih prijava nuspojava na lijekove (vidi Sliku 5.).
Najveća promjena u 2011. godini je porast broja prijava od strane nositelja odobrenja; HALMED je zaprimio 681 prijavu od strane nositelja odobrenja za stavljanje gotovog lijeka u promet, što čini 33% ukupnog broja prijava. To je u Izvješćima HALMED-a najveći zabilježeni broj prijava od strane nositelja odobrenja, što pokazuje da nositelji odobrenja ozbiljno shvaćaju svoju ulogu u praćenju i nadziranju sigurnosnog profila svojih lijekova na tržištu. Tijekom 2011. godine, HALMED je zaprimio 16 prijava od pacijenata/korisnika lijeka (Tablica 4.). Prijavljivanje od strane pacijenata/korisnika lijekova ili njihovih zakonskih zastupnika omogućeno je Pravilnikom o farmakovigilanciji iz 2009. godine.
Tablica 4. Izvori spontanih prijava sumnji na nuspojave lijekova i cjepiva u 2011. godini (u zagradama broj prijava u 2010. godini)
| Izvor prijave | Broj prijava |
|---|---|
| Liječnik (bez specijalizacije) | 647 (412) |
| Liječnici specijalisti: | |
| Psihijatar | 49 (37) |
| Internist (nesp.) | 58 (31) |
| Dermatovenerolog | 16 (14) |
| Pedijatar | 56 (97) |
| Infektolog | 7 (9) |
| Ginekolog | 30 (5) |
| Specijalist obiteljske medicine | 77 (87) |
| Neurolog | 173 (4) |
| Epidemiolog | 21 (19) |
| Specijalist školske medicine | 77 (123) |
| Reumatolog | 4 (1) |
| Onkolog | 31 (5) |
| Fizijatar | 1 (10) |
| Endokrinolog | 8 (3) |
| Gastroenterolog | 4 (4) |
| Klinički farmakolog | 7 (10) |
| Anesteziolog | 8 (5) |
| Kardiolog | 2 (11) |
| Kirurg | 1 (0) |
| Pulmolog | 3 (4) |
| Transfuziolog | 23 (6) |
| Radiolog | 1 (1) |
| Hematolog | 1 (2) |
| Nefrolog | 2 (5) |
| Otorinolaringolog | 1 (4) |
| Spec. med. rada | 2 (0) |
| Citolog | 1 (0) |
| Oftalmolog | 1 (0) |
| LIJEČNICI SPECIJALISTI UKUPNO: | 665 (495) |
| Farmaceuti | 491 (271) |
| Stomatolozi | 0 (2) |
| Medicinske sestre | 44 (1) |
| Medicinski i farmaceutski tehničari | 2 (1) |
| Nepoznat izvor (zdravstveni radnici nepoznatog profila) | 162 (133) |
| Pacijenti | 16 (7) |
| UKUPNO SPONTANIH PRIJAVA: | 2027 |
Slika 4. Broj prijava po izvorima prijavitelja od 2005. do 2011. godine
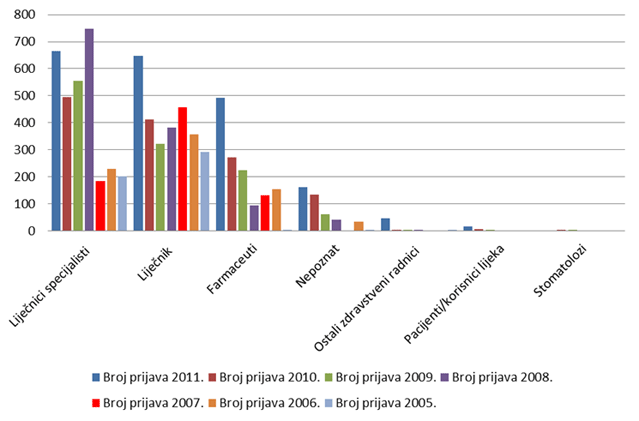
Slika 5. Broj prijava po specijalizacijama liječnika u razdoblju 2006. - 2011. godine za koje je specijalizacija poznata kroz prijavu nuspojave
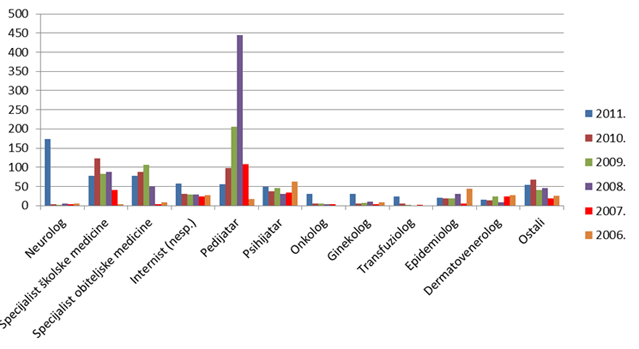
U kategoriji "nepoznat izvor prijave" (Slika 4. i Tablica 4.) poznato je da se radi o zdravstvenim radnicima, ali nije poznat njihov profil (liječnik, farmaceut itd.). Radi se o kategoriji koja se najčešće javlja kod prijava nositelja odobrenja te se na taj način objašnjava i porast broja prijavitelja u navedenoj kategoriji "nepoznat izvor prijave" tijekom 2009., 2010. i 2011. godine, što korelira s povećanim brojem prijava od strane nositelja odobrenja posljednjih nekoliko godina.
Slika 6. Udio prijava pojedinih struka zdravstvenih radnika od 2005. do 2011. godine
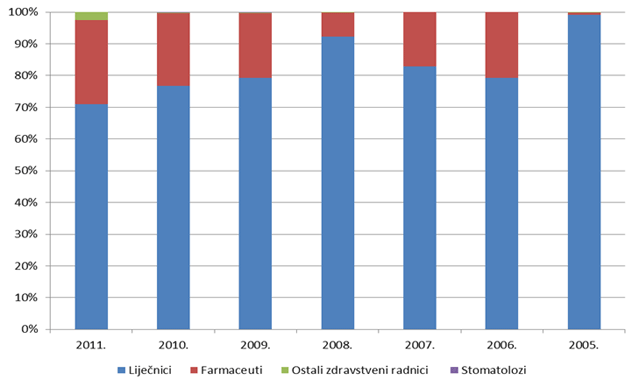
Slika 6. pokazuje udio pojedinih zdravstvenih radnika u prijavljivanju nuspojava u kojem tradicionalno dominiraju liječnici, ali od 2006. godine počinjemo bilježiti i prijave od strane farmaceuta. To je povezano s edukacijama o načinu, mjestu i značenju prijavljivanja nuspojava od strane farmaceuta koje HALMED provodi od 2005. godine. Tijekom godina bilježi se lagani pad do 2008. godine, da bi nakon toga udio prijava od strane farmaceuta ponovno počeo rasti i drži oko 20% svih prijavljenih nuspojava. U kategoriji "ostali zdravstveni radnici" u 2011. godini bilježimo određeni pomak. Naime, broj prijava od strane medicinskih sestara je značajno porastao na 44 prijave, što je najvećim dijelom rezultat održanih edukacija prema ovoj skupini zdravstvenih radnika. Prijave od strane medicinskih tehničara, farmaceutskih tehničara i stomatologa su, nažalost, još uvijek malobrojne te stoga HALMED planira dodatne edukacije navedenih zdravstvenih radnika u svrhu poticanja prijavljivanja nuspojava.
Udio broja prijava iz bolničkih ustanova porastao je s 23% u 2010. godini na 32% u 2011. godini (Tablica 5.). Uzevši u obzir informacije iz 2011. godine, čini se da napori HALMED-a u senzibilizaciji prijavitelja iz bolničkih ustanova ipak daju rezultata, što je i dodatni motiv da se program edukacije proširi na ostale bolničke ustanove diljem Hrvatske (Tablica 5. i Slika 7.). Također, važnost prijavljivanja nuspojava u osiguranju kvalitete pružene usluge svojim pacijentima neke su bolnice prepoznale i započele s vrlo kvalitetnim prijavama nuspojava. Ubuduće će HALMED objavljivati i pregled broja prijava po bolnicama u odnosu na broj kreveta i kategorizaciju bolnice kao indikatora kvalitete pružanja usluge pacijentima u smislu sigurne primjene lijekova. Nuspojave iz bolničkih ustanova su i inače od osobitog značaja jer obično produžuju hospitalizaciju ili dovode do hospitalizacije pa time uvijek pripadaju kategoriji ozbiljnih nuspojava.
Tablica 5. Izvori spontanih prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2011. godini (u zagradama su navedeni podaci iz 2010. godine)
| Ustanova | Broj prijava |
|---|---|
| Ljekarne | 480 (267) |
| Klinička bolnica ili Klinički bolnički centar | 465 (182) |
| Opće bolnice | 157 (101) |
| Specijalna bolnica | 36 (22) |
| Ordinacije obiteljske medicine | 186 (237) |
| Hrvatski zavod za javno zdravstvo | 5 (10) |
| Županijski zavodi za javno zdravstvo | 113 (172) |
| Pedijatrijska ordinacija | 46 (85) |
| Ginekološka ordinacija | 2 (2) |
| Psihijatrijska ordinacija | 35 (27) |
| Ordinacija školske medicine | 5 (2) |
| Ostalo | 33 (24) |
| Nepoznato | 464 (189) |
| UKUPNO PRIJAVA: | 2027 |
Slika 7. Udio pojedinih ustanova kao izvor prijavljivanja nuspojava u 2011. godini
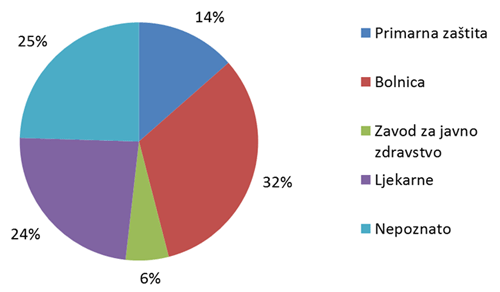
Slika 7. prikazuje udio pojedinih ustanova u prijavljivanju nuspojava. U primarnu zdravstvenu zaštitu uračunate su prijave ordinacija obiteljske medicine, ginekoloških i pedijatrijskih ordinacija, a u bolničku zaštitu sve vrste bolnica i bolničkih centara. Posebno su izdvojeni zavodi za javno zdravstvo, koji su važni u sustavu prijavljivanja nuspojava cjepiva, te ljekarne. Ukupno 25% ustanova nije identificirano kroz prijavu, što je posljedica povećanog broja prijava od strane nositelja odobrenja gdje ova informacija nekad nedostaje iz razloga što elektronički sustavi pojedinih nositelja odobrenja ne prosljeđuju ovu informaciju.
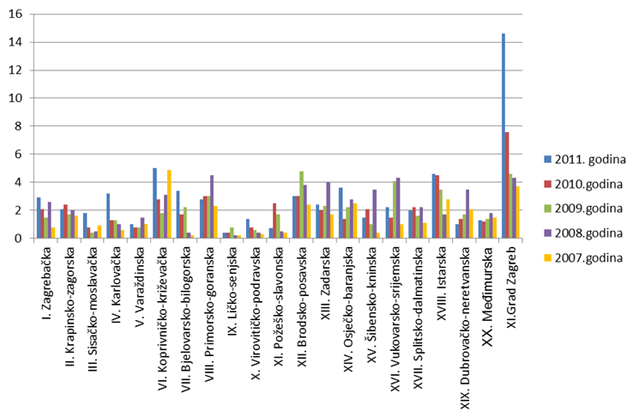
HALMED je i u 2011. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. U 13 županija zabilježen je porast broja prijava u odnosu na 2010. godinu. Najviše prijava zaprimljeno je s područja Grada Zagreba - 1127, zatim slijede Istarska (93 prijave) i Splitsko-dalmatinska županija (91 prijava).
Prosječan broj prijava izražen na 10 000 stanovnika za cijelu Republiku Hrvatsku porastao je u odnosu na 2010. godinu i sada iznosi 4,6 prijava. U odnosu na prosjek Republike Hrvatske, samo Grad Zagreb i Koprivničko-križevačka županija bilježe iznadprosječne rezultate, Istarska županija bilježi rezultat jednak prosjeku, a sve su ostale županije ispod državnog prosjeka. Razlog izraženog porasta broja prijava iz Grada Zagreba posljedica je povećanog broja prijava od strane nositelja odobrenja i činjenice da su njihova sjedišta upravo u Zagrebu te povećanog broja prijava iz velikih bolničkih ustanova koji se također nalaze u Gradu Zagrebu.
Na temelju ovih podataka HALMED će i dalje planirati održavanje Radionica o ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske.
Tablica 6. Izvori prijava nuspojava lijekova i cjepiva prema županijama u 2011. godini u usporedbi s 2007., 2008., 2009. i 2010. godinom
| Županija | Broj prijava u 2011. godini (u zagradi u 2010. godini) | Broj prijava na 10 000 stanovnika 2011. | Broj prijava na 10 000 stanovnika 2010-2009-2008-2007 |
|---|---|---|---|
| I. Zagrebačka | 86 (64) | 2,9 | 2,1 - 1,45 -2,6 - 0,8 |
| II. Krapinsko-zagorska | 29 (34) | 2,1 | 2,4 - 1,7 - 2 - 1,6 |
| III. Sisačko-moslavačka | 33 (15) | 1,8 | 0,8 - 0,43 - 0,5 - 0,9 |
| IV. Karlovačka | 45 (18) | 3,2 | 1,3 - 1,3 - 1 - 0,6 |
| V. Varaždinska | 18 (14) | 1 | 0,8 - 0,8 - 1,5 - 1,0 |
| VI. Koprivničko-križevačka | 60 (33) | 5 | 2,75 - 1,8 - 3,1 - 4,9 |
| VII. Bjelovarsko-bilogorska | 44 (22) | 3,4 | 1,7 - 2,15 - 0,4 - 0,2 |
| VIII. Primorsko-goranska | 84 (92) | 2,8 | 3 - 3 - 4,5 - 2,3 |
| IX. Ličko-senjska | 2 (2) | 0,4 | 0,4 - 0,8 - 0,2 - 0,2 |
| X. Virovitičko-podravska | 13 (7) | 1,4 | 0,8 - 0,55 - 0,4 - 0,3 |
| XI. Požeško-slavonska | 6 (20) | 0,75 | 2,5 - 1,65 - 0,5 - 0,35 |
| XII. Brodsko-posavska | 51 (53) | 3 | 3 - 4,8 - 3,8 - 2,4 |
| XIII. Zadarska | 39 (32) | 2,4 | 2 - 2,25 - 4 - 1,7 |
| XIV. Osječko-baranjska | 118 (47) | 3,6 | 1,4 - 2,2 - 2,8 - 2,5 |
| XV. Šibensko-kninska | 16 (23) | 1,5 | 2,1 - 1 - 3,45 - 0,4 |
| XVI. Vukovarsko-srijemska | 45 (29) | 2,2 | 1,45 - 4,1 - 4,25 - 1,0 |
| XVII. Splitsko-dalmatinska | 91 (102) | 2 | 2,2 - 1,6 - 2,15 - 1,1 |
| XVIII. Istarska | 93 (90) | 4,6 | 4,5 - 3,5 - 1,7 - 2,8 |
| XIX. Dubrovačko-neretvanska | 12 (17) | 1 | 1,4 - 1,7 - 3,5 - 2,1 |
| XX. Međimurska | 15 (14) | 1,3 | 1,2 - 1,4 - 1,8 - 1,5 |
| Grad Zagreb | 1127 (593) | 14,6 | 7,6 - 4,55 - 4,25 - 3,7 |
| UKUPNO PRIJAVA: | 2027 | 4,6 | 3 - 2,6 - 2,85 - 1,4 |
Slika 8. Broj prijava na 10 000 stanovnika po županijama za razdoblje 2007. - 2011. godine
1.2. Karakteristike prijava nuspojava lijekova i cjepiva
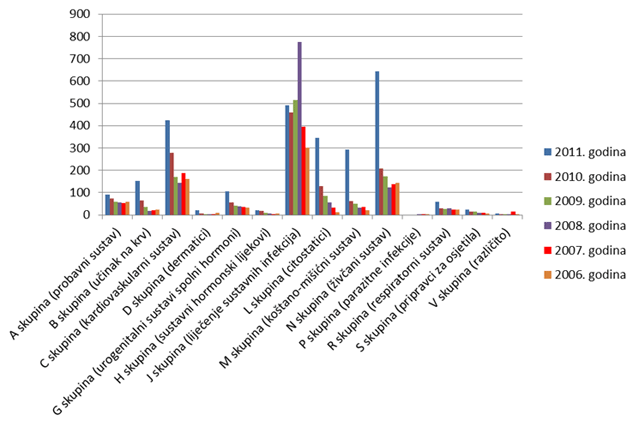
Tri najzastupljenije skupine lijekova iz prethodnih godina prema broju prijava nuspojava (skupine N, J i C) ostale su u vrhu i tijekom 2011. godine, ali je u povećanju broja prijava u odnosu na prethodnu godinu prednjačila skupina N (Lijekovi za živčani sustav) za koju je broj prijava utrostručen. Na drugom mjestu su lijekovi iz skupine J (Lijekovi za liječenje sustavnih infekcija), za koje je prijavljeno 490 sumnji na nuspojavu. Vrijedi istaknuti da se u 2011. godini više nego udvostručio broj prijava za lijekove iz skupine B, zbog povećanog broja prijava nuspojava za varfarin (projekt individualizacije terapije - farmakogenomika), te gotovo upeterostručio broj prijava za lijekove iz skupine M (Lijekovi za koštano-mišićni sustav) u odnosu na 2010. godinu. Ukupan broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava jer se u jednoj prijavi mogu naznačiti sumnje na nuspojave više lijekova (Tablica 7.).
Tablica 7. Apsolutni broj lijekova za koje je prijavljena sumnja na nuspojave prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji (usporedba s 2010. godinom)
| ATK klasifikacija | Broj lijekova za koje je prijavljena sumnja na nuspojave po ATK klasifikaciji | |
|---|---|---|
| 2011. | 2010. | |
| ATK 1. razina A skupina (probavni sustav) | 92 | 73 |
| ATK 1. razina B skupina (učinak na krv) | 152 | 64 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 424 | 278 |
| ATK 1. razina D skupina (dermatici) | 21 | 5 |
| ATK 1. razina G skupina (urogenitalni sustavi spolni hormoni) | 106 | 56 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 20 | 18 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 490 | 460 |
| ATK 1. razina L skupina (citostatici) | 345 | 130 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 292 | 63 |
| ATK 1. razina N skupina (živčani sustav) | 643 | 209 |
| ATK 1. razina P skupina (parazitne infekcije) | 0 | 0 |
| ATK 1. razina R skupina (respiratorni sustav) | 58 | 30 |
| ATK 1. razina S skupina (pripravci za osjetila) | 24 | 16 |
| ATK 1. razina V skupina (različito) | 7 | 3 |
| UKUPNO LJEKOVA: | 2709 | 1405 |
Slika 9. Apsolutni broj lijekova za koje je prijavljena sumnja na nuspojave prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2011. godine
Kako se da uočiti iz Tablice 8., u 2011. godini izražen je pad broja prijava sumnji na nuspojave u mlađim dobnim kategorijama , što pripisujemo nastavku pada broja prijava sumnji na nuspojave cjepiva. Za središnje dobne skupine, kao i za one najstarije, uočljiv je izraziti porast broja prijava.
Tablica 8. Prijave sumnji na nuspojave lijekova prema dobi bolesnika za 2011. godinu u usporedbi s 2010., 2009. i 2008. godinom
| Dob bolesnika | Broj prijava u 2011. godini | Broj prijava u 2010. godini | Broj prijava u 2009. godini | Broj prijava u 2008. godini |
|---|---|---|---|---|
| Do 12 mjeseci | 20 | 37 | 87 | 131 |
| 1 do 2 godine | 24 | 21 | 105 | 295 |
| 3 do 6 godina | 61 | 136 | 90 | 112 |
| 7 do 14 godina | 110 | 143 | 99 | 104 |
| 15 do 17 godina | 21 | 16 | 22 | 13 |
| 18 do 40 godina | 344 | 179 | 164 | 119 |
| 41 do 64 godine | 774 | 371 | 313 | 237 |
| 65 do 74 godina | 274 | 213 | 155 | 141 |
| 75 do 84 godina | 171 | 101 | 80 | 71 |
| 85 godina i starije | 17 | 6 | 4 | 8 |
| Neupisana dob | 178 | 101 | 46 | 34 |
| UKUPNO: | 2027 | 1322 | 1165 | 1265 |
Tablica 9. Prijave sumnji na nuspojavu prema spolu bolesnika (usporedba s podacima iz 2007., 2008., 2009. i 2010. godine)
| Spol | Broj prijava u 2011. godini | % ukupnog broja prijava u 2011. godini | % ukupnog broja prijava u 2010. godini | % ukupnog broja prijava u 2009. godini | % ukupnog broja prijava u 2008. godini | % ukupnog broja prijava u 2007. godini |
|---|---|---|---|---|---|---|
| Muškarci | 780 | 39 | 42 | 39 | 47 | 44 |
| Žene | 1219 | 60 | 55 | 58 | 52 | 54 |
| Nepoznato | 28 | 1 | 3 | 3 | 1 | 2 |
| UKUPNO: | 2027 | 100 | 100 | 100 | 100 | 100 |
Slika 10. Prijava sumnji na nuspojave po spolu bolesnika u 2011. godini
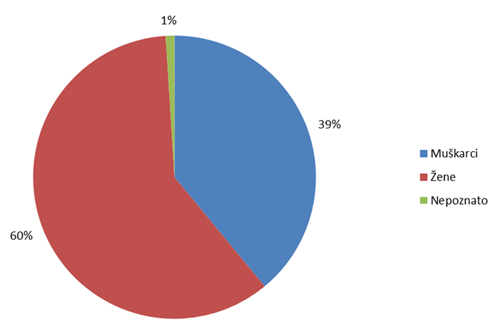
Statistika koju HALMED vodi za sumnje na nuspojave lijekova već sedmu godinu zaredom pokazuje da je veći broj prijava sumnji na nuspojavu zabilježen kod osoba ženskog spola. U odnosu na 2010. godinu, zabilježen je porast broja takvih prijava za 11%.
Nuspojave se osnovno dijele na nuspojave tipa A (posljedica pretjeranog farmakološkog učinka) i nuspojave tipa B, u koje spadaju imunoalergijske reakcije, pseudoalergijske reakcije, metabolička intolerancija i idiosinkrazije. Od ukupno 4769 prijavljenih nuspojava, u 781 slučaju možemo govoriti o reakcijama tipa B, što čini 16% svih nuspojava, neznatno više nego u 2010. godini.
U uzorku iz 2011. godine među osobama kod kojih se javljaju nuspojave tipa B dominiraju osobe ženskog spola. U 2% prijava spol nije bio poznat (Tablica 11.).
Uočava se porast broja prijava sumnji na nedjelotvornost lijekova (tip F) pa te prijave u 2011. godini čine 4% ukupnog broja. Uobičajeno nakon takvih prijava slijedi regulatorna akcija provjere kakvoće proizvoda na koji je takva nuspojava prijavljena.
Tablica 10. Vrste prijavljenih nuspojava u 2011. godini u usporedbi s prijavama iz 2010., 2009. i 2008. godine
| Vrsta nuspojava | Broj nuspojava 2011. | Broj nuspojava 2010. | Broj nuspojava 2009. | Broj nuspojava 2008. | % 2011. | % 2010. | % 2009. | % 2008. |
|---|---|---|---|---|---|---|---|---|
| Tip A | 3810 | 2432 | 1981 | 1801 | 80 | 84 | 84 | 81,4 |
| Tip B | 781 | 439 | 358 | 395 | 16 | 15 | 15 | 17,8 |
| Tip F | 178 | 16 | 16 | 16 | 4 | 1 | 1 | 0,8 |
| UKUPNO: | 4769 | 2887 | 2355 | 2212 | 100 | 100 | 100 | 100 |
Tablica 11. Odnos spola i reakcija tipa B u 2011. godini u usporedbi s podacima iz 2010. i 2009. godine (u zagradama)
| Spol | Broj nuspojava tipa B | % |
|---|---|---|
| Muškarci | 245 (169) (111) | 31 (39) (31) |
| Žene | 522 (257) (242) | 67 (58) (68) |
| Nepoznato | 14 (13) (5) | 2 (3) (1) |
| UKUPNO: | 781 (439) (358) | 100 |
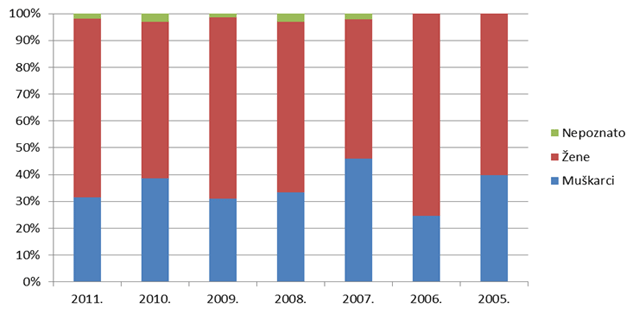
Slika 11. Udio nuspojava tipa B po spolu bolesnika/korisnika lijekova u razdoblju 2005. - 2011. godine
1.2.4. Broj lijekova u istovremenoj primjeni
Što se tiče odnosa dobi bolesnika i broja lijekova koje bolesnik istovremeno primjenjuje, u 2011. godini nije bilo većih promjena kod mlađih dobnih skupina, čija zastupljenost u ukupnom broju lijekova u istovremenoj primjeni pada iz godine u godinu, prvenstveno zbog manjeg broja prijava sumnji na nuspojave cjepiva. Najveći pomaci mogu se primijetiti u središnjim dobnim skupinama (18-40 godina i 41-64 godine) gdje je uočljiv značajan porast broja lijekova u istovremenoj primjeni u odnosu na ranije godine. Uzimanjem više lijekova istovremeno eksponencijalno se povećava mogućnost interakcije između brojnih lijekova, a time i mogućnost pojave nuspojava koje su posljedica interakcija (Tablica 12.).
Tablica 12. Dob bolesnika i broj lijekova koje bolesnik istovremeno primjenjuje (u zagradi podaci za 2010. godinu)
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | UKUPNO |
|---|---|---|---|---|---|
| Do 12 mjeseci | 17 (27) | 3 (10) | 0 | 0 | 20 (37) |
| 1-2 godine | 17 (18) | 2 (2) | 1 (1) | 0 | 20 (21) |
| 3-6 godina | 34 (130) | 4 (6) | 3 | 0 | 41 (136) |
| 7-14 godina | 115 (127) | 8 (15) | 4 | 2 (1) | 129 (143) |
| 15-17 godina | 7 (10) | 7 (4) | 3 (2) | 1 | 18 (16) |
| 18-40 godina | 246 (99) | 189 (60) | 38 (14) | 20 (6) | 493 (179) |
| 41-64 godine | 256 (107) | 266 (154) | 151 (78) | 76 (32) | 749 (371) |
| 65-74 godina | 66 (45) | 82 (66) | 71 (65) | 52 (37) | 271 (213) |
| 75-84 godina | 39 (24) | 46 (30) | 64 (33) | 21 (14) | 170 (101) |
| > 85 godina | 2 (1) | 3 (1) | 5 (4) | 8 (0) | 18 (6) |
| Neupisano | 58 (80) | 22 (14) | 13 (5) | 5 (0) | 98 (99) |
| UKUPNO: | 857 (668) | 632 (362) | 353 (202) | 185 (89) | 2027 (1322) |
Slika 12. Udio prijava s 2-3 lijeka u istovremenoj primjeni po dobnim skupinama u odrasloj dobi za razdoblje 2005. - 2011. godine

Slika 13. Udio prijava s 4-5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi za razdoblje 2005. - 2011. godine
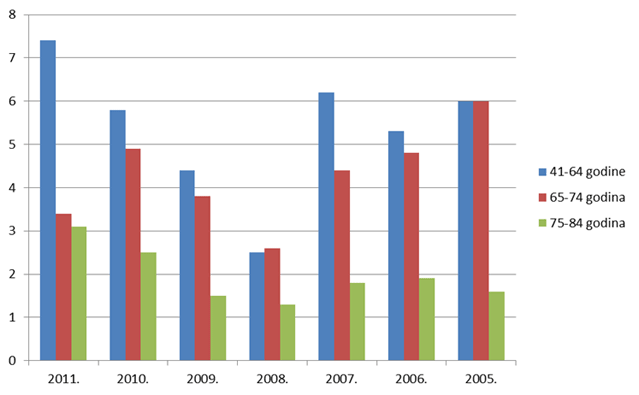
Slika 14. Udio prijava s više od 5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi za razdoblje 2005. - 2011. godine
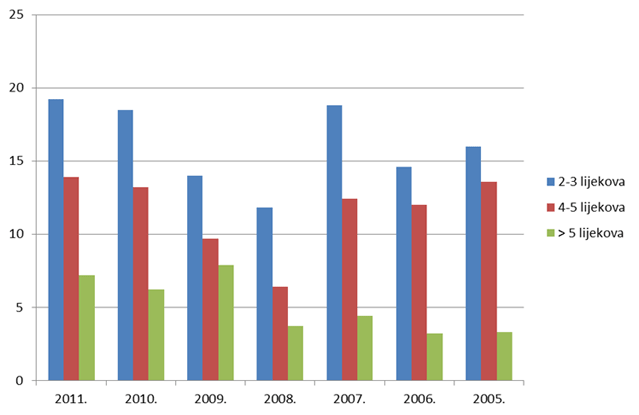
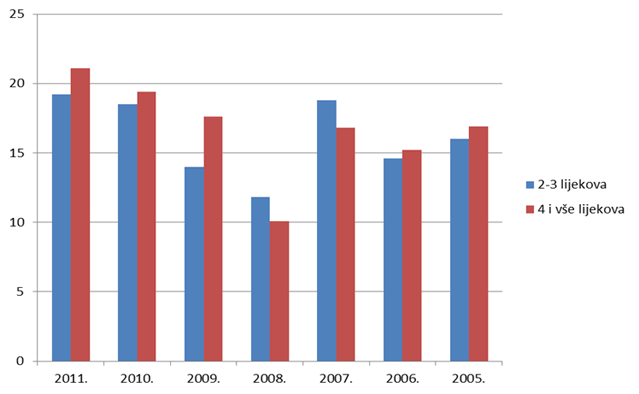
Slika 15. Udio prijava s više lijekova u istovremenoj primjeni u starijih odraslih bolesnika/korisnika lijeka od 41 do 84 godine života u razdoblju 2005. - 2011. godine
U 2011. godini broj nuspojava koje ne ispunjavaju niti jedan od kriterija za ozbiljnu nuspojavu veći je od broja onih koji takve kriterije ispunjavaju. Nuspojave koje zadovoljavaju najmanje jedan od navedenih kriterija smatraju se u regulatornom smislu ozbiljnima:
- ako se radi o medicinski značajnom stanju koje se može smatrati ozbiljnim
- ako je nuspojava uzrokovala hospitalizaciju (bolničko liječenje) ili produženje hospitalizacije
- ako je došlo do razvoja anomalije kod novorođenčeta zbog toga što je majka uzimala lijek tijekom trudnoće
- ako je nuspojava izazvala invalidnost ili trajnu nesposobnost
- ako nuspojava ugrožava život bolesnika/korisnika lijeka
- ako je nuspojava izazvala smrt osobe.
Razlozi za općenito visok udio ozbiljnih nuspojava među prijavljenim nuspojavama mogu se pronaći u sve većem broju prijava iz bolničkih ustanova, velikom broju lijekova u istovremenoj primjeni te metodološkim promjenama koje je HALMED uveo pri ocjeni ozbiljnosti nuspojava (poštujući smjernice EMA-e vezane uz ocjenu ozbiljnosti nuspojava koje spadaju pod MedDRA organski sustav (SOC) Infekcije i infestacije te preporuke skupine Brighton Colaboration, tj. smjernice Svjetske zdravstvene organizacije (WHO) za ocjenu nuspojava cjepiva.
Kao što se može vidjeti iz Tablice 14., udio prijava sumnji da je nuspojava određenog lijeka uzrokovala smrtni slučaj u 2011. godini niži je u odnosu na ranije godine.
Tablica 13. Ozbiljnost prijavljenih nuspojava u 2011. godini (uz usporedbu s udjelom prijava s ozbiljnim nuspojavama za razdoblje 2007. - 2010. godine)
| Ozbiljnost nuspojave | Apsolutni broj prijava u 2011. | % u 2011. | % u 2010. | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|---|
| Ozbiljne | 981 | 48 | 52 | 46 | 50,7 | 26 |
| Ostale | 1046 | 52 | 48 | 54 | 49,3 | 74 |
| UKUPNO: | 2027 | 100 | 100 | 100 | 100,0 | 100 |
Tablica 14. Ozbiljne nuspojave prijavljene u 2011. godini - kriteriji prema ICH smjernici E2A u usporedbi s 2007., 2008., 2009. i 2010. godinom (u zagradi broj prijava)
| Kriterij | Broj prijava u 2011. godini | % u 2011. | % u 2010. | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|---|
| Smrt | 13 | 1 | 3 (23) | 2 (10) | 4 (26) | 4 |
| Hospitalizacija | 212 | 21 | 23 (161) | 20 (110) | 20,2 (132) | 41 |
| Invalidnost | 0 | 0 | 0 (0) | 0 (0) | 0 (0) | 0 |
| Ugrožava život | 49 | 5 | 6 (44) | 4,5 (25) | 5,1 (33) | 14 |
| Prirođena anomalija | 0 | 0 | 1 (5) | 0,5 (2) | 0 (0) | 0 |
| Medicinski značajno ozbiljno stanje | 732 | 73 | 66 (474) | 73,0 (402) | 70,7 (461) | 37 |
| UKUPNO: | 1006* | 100 | 100 | 100 | 100 | 100 |
*neke nuspojave ispunjavaju nekoliko kriterija ozbiljnosti pa je ukupan zbroj u Tablici 14. veći od ukupnog broja prijava ozbiljnih uspojava
U 2011. godini nije bilo velikih promjena prema zastupljenosti pojedinih vrsta ishoda nuspojava u odnosu na 2010. godinu, ali se, nažalost, nastavio povećavati broj prijava koje nemaju podatke o ishodu nuspojave. Razlog se može pronaći u visokom udjelu prijava od strane farmaceuta i nositelja odobrenja, čije prijave u pravilu ne sadrže ovaj podatak (Tablica 15). HALMED će putem dodatnih edukativnih aktivnosti pokušati poboljšati ovaj pokazatelj kvalitete prijava.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u 13 slučajeva. Od navedenih 13 prijava, u dva je slučaja nuspojava označena kao nepovezana sa smrtnim ishodom; u četiri je slučaja označena kao moguće doprinoseća smrtnom ishodu, dok je u sedam slučajeva ocijenjeno kako je nuspojava vjerojatno povezana sa smrtnim ishodom, ali u niti jednom od ovih slučajeva nije se mogla utvrditi sigurna povezanost između primjene lijeka i smrtnog ishoda. Važno je naglasiti kako se u najvećem broju smrtnih slučajeva za koje se sumnja da su povezani s lijekovima radi o bolesnicima s teškom osnovnom bolešću (npr. multipli mijelom, kolorektalni karcinom, rak dojke, itd.), što dodatno otežava procjenu povezanosti lijeka i nuspojave sa smrtnim ishodom. Uglavnom je bila riječ o osobama starije životne dobi, npr. pacijenti između 60 i 85 godina.
Tablica 15. Udio nuspojava lijekova i cjepiva prijavljenih u 2011. godini s ishodom nuspojava u usporedbi s 2010., 2009. i 2008. godinom
| Ishod nuspojave | 2011. (2010.) | % u 2011. | % u 2010. | % u 2009. | % u 2008. |
|---|---|---|---|---|---|
| Oporavak bez posljedica | 2479 (1537) | 52 | 53 | 59 | 54,2 |
| Oporavak s posljedicama | 50 (27) | 1 | 1 | 0,5 | 0,3 |
| U tijeku | 190 (251) | 4 | 9 | 5,5 | 20 |
| Bez oporavka/Nepoznato | 2018 (1017) | 42 | 35 | 34 | 23,5 |
1.2.7. Nuspojave po organskim sustavima
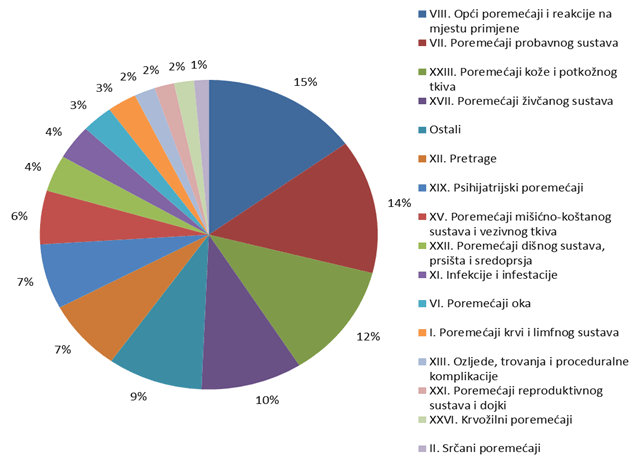
Nuspojave su navedene prema MedDRA-inoj klasifikaciji organskih sustava (MedDRA - Medical Dictionary for Regulatory Activities, odnosno Medicinski rječnik za regulatorne poslove), koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom polju. U 2011. godini prijavljene nuspojave su donekle ravnomjernije raspoređene po organskim sustavima (SOC) te bez najviših točaka koje su se mogle zamijetiti u nekim ranijim godinama. Najveći broj nuspojava zabilježen je za SOC-eve kao i prošlih godina: najviše je nuspojava iz SOC-a Opći poremećaji i reakcije na mjestu primjene (15% u usporedbi sa 17,7% u 2010.) uz zamjetan porast broja prijava. Slijede Poremećaji probavnog sustava (14% prema 12,9% iz 2010.) te Poremećaji kože i potkožnog tkiva s udjelom od 12% ukupnog broja prijava. HALMED je u 2011. godini zaprimio 16 prijava za SOC Dobroćudne, zloćudne i nespecificirane novotvorine, dok za SOC Prirođeni, obiteljski i genetski poremećaji nije bilo prijava (Tablica 16).
HALMED smatra da je potrebno i dalje veliku pozornost posvetiti nuspojavama iz područja genetskih poremećaja i malformacija zbog njihova značaja za sigurnost primjene lijekova u trudnoći i slijedom toga radit će se na educiranju i informiranju zdravstvenih radnika i pacijenata, a od 2013. godine i studenata medicine i farmacije u sklopu projekta farmakogenetike i nuspojava lijekova kojeg HALMED vodi zajedno s KBC Zagrebom i Medicinskim fakultetom u Zagrebu (Zavod za farmakologiju). Kao važan partner na tom području i dalje će biti nositelji odobrenja za stavljanje lijekova u promet.
Tablica 16. Nuspojave po MedDRA-inoj klasifikaciji organskih sustava u 2011. godini u usporedbi s udjelom
| Organski sustav (SOC) | Broj nuspojava u 2011. (2010.) | Udio (%) nuspojava u 2011. godini | Udio (%) nuspojava u 2010. godini | Udio (%) nuspojava u 2009. godini | Udio (%) nuspojava u 2008. godini | Udio (%) nuspojava u 2007. godini |
|---|---|---|---|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 136 (72) | 2,8 | 2,5 | 1,1 | 1,8 | 1,7 |
| II. Srčani poremećaji | 66 (78) | 1,4 | 2,7 | 1,8 | 1,4 | 1,5 |
| III. Prirođeni, obiteljski i genetski poremećaji | 0 (5) | 0,0 | 0,2 | 0,1 | 0,0 | 0,2 |
| IV. Poremećaji uha i labirinta | 73 (39) | 1,5 | 1,4 | 1,3 | 1,0 | 1,2 |
| V. Endokrini poremećaji | 19 (23) | 0,4 | 0,8 | 0,1 | 0,1 | 0,2 |
| VI. Poremećaji oka | 149 (74) | 3,0 | 2,6 | 2,5 | 2,7 | 2,7 |
| VII. Poremećaji probavnog sustava | 689 (371) | 14,0 | 12,9 | 14,5 | 12,7 | 19,1 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 726 (511) | 15,0 | 17,7 | 23,2 | 27,7 | 17,2 |
| IX. Poremećaji jetre i žuči | 27 (15) | 0,6 | 0,5 | 0,6 | 0,5 | 0,3 |
| X. Poremećaji imunološkog sustava | 67 (26) | 1,4 | 0,9 | 0,6 | 1,1 | 1,8 |
| XI. Infekcije i infestacije | 171 (213) | 3,6 | 7,4 | 6,0 | 14,7 | 5,8 |
| XII. Pretrage | 356 (147) | 7,4 | 5,1 | 4,3 | 3,6 | 3,2 |
| XII. Ozljede, trovanja i proceduralne komplikacije | 99 (45) | 2,0 | 1,6 | 0,7 | 0,4 | 0,0 |
| XIV. Poremećaji metabolizma i prehrane | 72 (30) | 1,5 | 1,0 | 0,9 | 0,7 | 1,3 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 269 (154) | 5,6 | 5,3 | 4,5 | 2,7 | 3,5 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 16 (8) | 0,3 | 0,3 | 0,1 | 0,1 | 0,3 |
| XVII. Poremećaji živčanog sustava | 461 (274) | 9,7 | 9,5 | 12,1 | 8,0 | 10,0 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 5 (10) | 0,1 | 0,3 | 0,1 | 0,1 | 0,3 |
| XIX. Psihijatrijski poremećaji | 325 (120) | 6,8 | 4,2 | 5,1 | 3,0 | 3,5 |
| XX. Poremećaji bubrega i mokraćnog sustava | 68 (41) | 1,4 | 1,4 | 0,8 | 1,0 | 0,9 |
| XXI. Poremećaji reproduktivnog sustava i dojki | 92 (64) | 1,9 | 2,2 | 1,1 | 0,6 | 1,3 |
| XXII. Poremećaji dišnog sustava, prsišta i sredoprsja | 180 (132) | 3,8 | 4,6 | 3,9 | 3,7 | 4,4 |
| XXIII. Poremećaji kože i potkožnog tkiva | 574 (354) | 12,0 | 12,3 | 12,1 | 10,8 | 18,5 |
| XXIV. Socijalne okolnosti | 24 (4) | 0,5 | 0,1 | 0,1 | 0,1 | 0,1 |
| XXV. Operativni i medicinski postupci | 15 (25) | 0,3 | 0,9 | 0,1 | 0,0 | 0,0 |
| XXVI. Krvožilni poremećaji | 90 (52) | 1,9 | 1,8 | 2,2 | 1,6 | 0,9 |
| UKUPNO: | 4769 | 100 | 100 | 100 | 100 | 100 |
Slika 16. Udio nuspojava prema organskim sustavima u 2011. godini
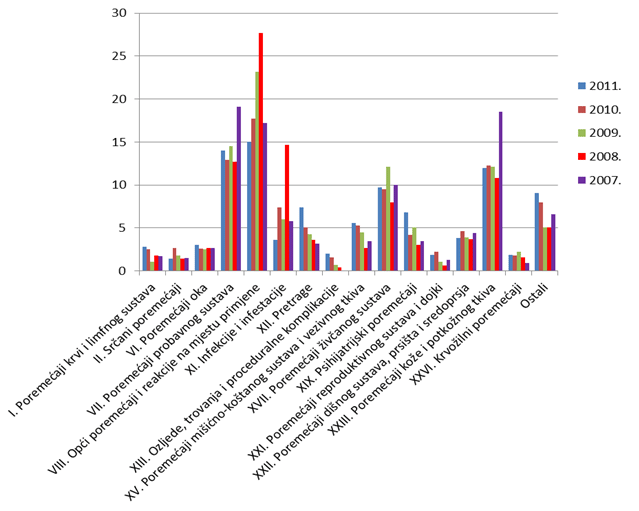
Slika 17. Udio nuspojava klasificiranih prema organskim sustavima po prijavama za razdoblje 2007.-2011. godine
1.2.8. Najčešće prijavljene nuspojave u 2011. godini
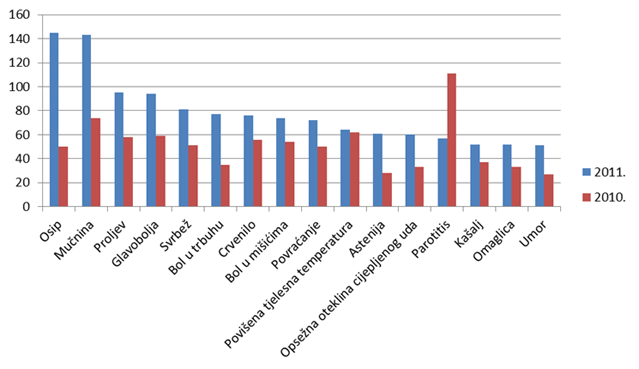
Tablica 17. Najčešće prijavljene nuspojave u 2011. godini u usporedbi s prijavama iz 2010. godine
| Nuspojava | Broj prijava u 2011. godini |
Broj prijava u 2010. godini |
|---|---|---|
| Osip | 145 | 50 |
| Mučnina | 143 | 74 |
| Proljev | 95 | 58 |
| Glavobolja | 94 | 59 |
| Svrbež | 81 | 51 |
| Bol u trbuhu | 77 | 35 |
| Crvenilo | 76 | 56 |
| Bol u mišićima | 74 | 54 |
| Povraćanje | 72 | 50 |
| Vrućica | 64 | 62 |
| Astenija | 61 | 28 |
| Otekline okrajina | 60 | 33 |
| Parotitis | 57 | 111 |
| Vrtoglavica | 52 | 37 |
| Kašalj | 52 | 33 |
| Umor | 51 | 27 |
Kao i u prošlogodišnjem izvješću, donosimo pregled najčešće prijavljenih nuspojava. Navedene su samo one nuspojave koje su prijavljene više od 50 puta. U usporedbi s 2010. godinom, iste nuspojave zauzimaju prvih dvadesetak mjesta s nešto promijenjenim udjelom u ukupnom broju nuspojava. U 2011. godini veći udio čine nuspojave kao što su osip, mučnina, proljev, bol u mišićima, povraćanje, što su nuspojave koje su karakteristične za klasične sintetske lijekove. Pretpostavlja se da se u praksi dio simptoma ne prepozna kao nuspojava lijekova već se dijagnosticira "nova bolest" (hipertenzija, kardiovaskularni incidenti, prijelom kostiju, razvoj depresije).
Smanjeni broj prijava "parotitis" u 2011. godini posljedica je promjene cjepiva protiv parotitisa u obveznom kalendaru cijepljenja što je učinjeno, u suradnji s HZJZ-om, nakon što je uočen veliki broj prijava postvakcionalnog parotitisa jednog proizvođača. Postvakcionalni parotitis je očekivana nuspojava takvih vrsta cjepiva, ali se ne smije pojavljivati u većem broju slučajeva nego što je to uobičajeno i očekivano za ta cjepiva.
Slika 18. Grafički prikaz najčešće prijavljenih nuspojava u 2011. godini u odnosu na 2010. godinu
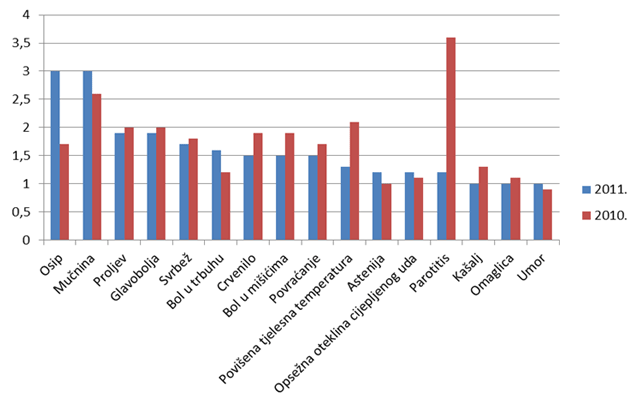
Slika 19. Grafički prikaz udjela najčešće prijavljenih nuspojava u odnosu na ukupan broj prijavljenih nuspojava u 2011. godini te usporedba s 2010. godinom
2. Pregled najvažnijih sigurnosnih regulatornih akcija u 2011. godini
2.1. Ketoprofen
U veljači 2011. godine HALMED je promijenio način izdavanja lijekova za lokalnu primjenu s djelatnom tvari ketoprofen (Ketonal® 5% krema, KetoGel® 2,5% gel i Ketospray® 10% i Fastum® Gel) iz bezreceptnog u receptni.
Promjena statusa izdavanja navedenih lijekova jedna je od mjera minimalizacije rizika razvoja ozbiljnih fotoalergijskih reakcija prilikom primjene topičkog ketoprofena te rizika ko-senzibilizacije prilikom istodobne primjene kozmetičkih proizvoda koji sadrže UV filter oktokrilen.
Pod nadzorom HALMED-a, uz promjenu statusa izdavanja, provedene su dodatne mjere minimalizacije rizika primjene ovih lijekova: upućeno je pismo zdravstvenim radnicima o promjeni načina izdavanja ovih lijekova s pripadajućim preporukama, izmijenjeni su Sažetci opisa svojstava lijeka i Upute o lijeku, dodani su piktogrami na vanjsko pakiranje lijeka te se kontinuirano komuniciraju informacije o ispravnoj primjeni topičkog ketoprofena.
2.2. Stavudin
HALMED je ograničio indikaciju lijeka Zerit (stavudin) u odraslih i djece zbog potencijalno ozbiljnih nuspojava koje uključuju laktacidozu, lipoatrofiju i perifernu neuropatiju.
Zerit je lijek iz skupine nukleozidnih inhibitora reverzne transkriptaze (NRTI) koji se koristi u liječenju bolesnika zaraženih HIV-om u sklopu kombinirane terapije s drugim antiretrovirusnim lijekovima.
Odluka o ograničavanju indikacije donesena je nakon provedene evaluacije novih post-marketinških sigurnosnih izvješća i objavljene literature koja se odnosi na nuspojave Zerita. Poznato je da ovaj lijek ima toksični učinak na mitohondrije, što dovodi do nuspojava kao što su laktacidoza, lipoatrofija i periferna neuropatija. Riječ je o ozbiljnim nuspojavama koje se obično javljaju uz dugoročnu primjenu ovog lijeka i češće se javljaju uz Zerit nego uz druge lijekove iz skupine nukleozidnih inhibitora reverzne transkriptaze. Zbog toga je njegova primjena ograničena te je ovaj lijek indiciran samo u onih odraslih bolesnika i djece starije od 3 mjeseca u kojih ne mogu biti korišteni drugi antiretrovirusni lijekovi. Trajanje liječenja Zeritom mora biti ograničeno na najkraći mogući vremenski period, a stanje bolesnika koji se trenutno nalaze na terapiji Zeritom nužno je učestalo procjenjivati te im promijeniti terapiju u drugi odgovarajući oblik liječenja kad god je to moguće.
Pod nadzorom HALMED-a, upućeno je pismo zdravstvenim radnicima o ograničavanju indikacije ovog lijeka u odraslih i djece s pripadajućim preporukama i daljnjim informacijama.
2.3. Kodein
HALMED je ograničio indikacije, dodao nova upozorenja i uputio smjernice ljekarnicima za strožu kontrolu izdavanja bezreceptnih lijekova koji sadrže djelatnu tvar kodein (Caffetin tablete, Plivadon tablete, Solpadeine tablete, Solpadeine šumeće tablete i Solpadeine kapsule) kako bi se smanjio rizik njihove prekomjerne upotrebe i nastanka ovisnosti.
Indikacija za primjenu bezreceptnih lijekova koji sadrže kodein od ožujka 2011. godine ograničena je samo na kratkotrajno liječenje akutne, umjerene boli koja se ne smanjuje primjenom samog paracetamola, ibuprofena ili acetilsalicilatne kiseline.
Pod nadzorom HALMED-a, upućeno je pismo ljekarnicima o ograničavanju indikacije s uputama za izdavanje ovih lijekova te su nova upozorenja uvrštena u Sažetak opisa svojstava lijeka, Uputu u lijeku i na vanjsko pakovanje svih lijekova na tržištu Republike Hrvatske koji sadrže djelatnu tvar kodein, a izdaju se bez recepta. Dodano je upozorenje u kojem se navodi da kodein može uzrokovati ovisnost ako se uzima kontinuirano dulje od 3 dana. Također, ukoliko se lijek koristi za liječenje glavobolje dulje od 3 dana uzastopce, glavobolje se mogu pogoršati.
2.4. Pioglitazon
HALMED je uveo nove kontraindikacije i upozorenja u Sažetak opisa svojstava lijeka i Uputu o lijeku za lijekove s djelatnom tvari pioglitazon (MEDiGlitazon tablete, Pio tablete i Pioglitazon Pliva tablete) te je uputio pismo liječnicima u kojem su detaljno navedene preporuke o primjeni pioglitazona.
Od rujna 2011. godine, pioglitazon je kontraindiciran kod bolesnika s: aktivnim karcinomom mokraćnog mjehura ili karcinomom mokraćnog mjehura u anamnezi ili makroskopskom hematurijom neutvrđene etiologije.
Naime, na temelju dostupnih podataka zaključeno je da postoji relativno malo povećanje rizika od karcinoma mokraćnog mjehura povezano s liječenjem pioglitazonom. Međutim, određeni bolesnici, koji ne mogu biti odgovarajuće kontrolirani drugim antidijabeticima, mogu imati koristi od liječenja pioglitazonom te korist liječenja pioglitazonom u ovom trenutku nadmašuje rizik u onih bolesnika koji su dobro regulirani.
Lijekovi s djelatnom tvari pioglitazon namijenjeni su liječenju šećerne bolesti tipa II kao monoterapija ili u kombinaciji s drugim lijekovima.
2.5. Buflomedil
HALMED je od 1. lipnja 2011. godine zabranio uvoz lijekova koji sadrže djelatnu tvar buflomedil (lijekovi Buflomedil i Loftyl) zbog uočenog rizika za nastanak ozbiljnih kardijalnih i neuroloških nuspojava.
Ova odluka je donesena na temelju ocjene podataka o prijavljenim slučajevima predoziranja te kardijalnim i neurološkim nuspojavama lijekova koji sadrže buflomedil kao djelatnu tvar pri čemu je ocijenjeno da je omjer koristi i rizika primjene buflomedila nepovoljan te se stoga ovaj lijek više ne smije uvoziti u Republiku Hrvatsku.
Budući da pacijenti liječeni buflomedilom, zbog ozbiljnosti svoje bolesti, nisu smjeli ostati bez lijeka prije nego što im se omogući adekvatna zamjenska terapija, HALMED je prije uvođenja zabrane uvoza buflomedila najavio liječnicima propisivačima skori prestanak uvoza i uveo prijelazno razdoblje tijekom kojeg su liječnici bili dužni promijeniti terapiju svojim pacijentima. Tijekom navedenog prijelaznog razdoblja HALMED je provodio povećani nadzor nad uvozom buflomedila te je liječnicima propisivačima uputio pismo s uputama za propisivanje ovog lijeka te mjerama koje su liječnici bili dužni poduzeti kako bi primjena buflomedila bila što sigurnija. Liječnici su pravovremeno reagirali na upućeno pismo te je pacijentima koji su liječeni buflomedilom omogućena adekvatna zamjenska terapija.
Buflomedil je periferni vazodilatator koji se koristio u liječenju okluzivne bolesti perifernih arterija i Raynaudova fenomena, a također je primjenjivan u liječenju drugih bolesti i stanja u kojima je ugrožena mikrocirkulacija. Ovaj se lijek još od 1976. godine nalazio na tržištu više europskih zemalja. Na tržištu Republike Hrvatske nije bio registriran niti jedan lijek koji sadrži buflomedil, već su se za potrebe hrvatskih pacijenata do 1. lipnja 2011. godine ovi lijekovi uvozili temeljem pojedinačnih recepata za pacijente.
2.6. Citalopram
HALMED je ograničio dnevnu dozu lijekova s djelatnom tvari citalopram (Starcitin i Citalon) na 40 mg te je u Sažetak opisa svojstva lijeka i Uputu o lijeku uvrstio važne nove sigurnosne informacije, o čemu je upućeno pismo zdravstvenim radnicima. Citalopram je antidepresiv iz podskupine inhibitora ponovne pohrane serotonina (SSRI).
Primjena citaloprama je ograničena jer su novi podaci iz kliničke studije pokazali povezanost između primjene veće doze citaloprama i nastanka produljenja QT intervala. Produženje QT intervala je poremećaj u električkom provođenju srčanih impulsa (očitava se u EKG-u) koji može uzrokovati opasan oblik ventrikularne tahikardije (poremećaj ritma rada klijetki srca) koji se naziva Torsades de Pointes. Randomizirano multicentrično dvostruko slijepo kliničko ispitivanje je pokazalo jasnu povezanost mogućnosti nastanka ove nuspojave s dozom lijeka te je stoga donesena odluka o ograničavanju dnevne doze citaloprama.
2.7. Escitalopram
HALMED je ograničio primjenu lijekova s djelatnom tvari escitalopram (Cipralex, Citram, Elicea) te uveo nove kontraindikacije, upozorenja i interakcije za ove lijekove. HALMED je uputio Pismo zdravstvenim radnicima kako bi ih obavijestio o novim sigurnosnim informacijama za lijekove s djelatnom tvari escitalopram te je od nositelja odobrenja navedenih lijekova zatražio da u Sažetak opisa svojstava lijeka i Uputu o lijeku uvrste sve nove informacije.
Maksimalna preporučena doza za bolesnike starije od 65 godina je smanjena na 10 mg dnevno, a uvedene su i nove kontraindikacije, upozorenja i interakcije.
Nove preporuke za lijekove koji sadrže escitalopram rezultat su ocjene kliničkog ispitivanja QT intervala, koje je otkrilo o dozi lijeka ovisno produljenje QT intervala zapaženo EKG-om. Dodatno, analizom podataka prikupljenih spontanim prijavljivanjem nuspojava uočene su prijave produljenja QT intervala i ventrikularne aritmije, uključujući i Torsade de Pointes, koje su bile povezane s uzimanjem escitaloprama.
2.8. Dronedaron
HALMED je ograničio primjenu lijeka Multaq (dronedaron) na bolesnike s paroksizmalnom ili perzistentnom fibrilacijom atrija za održavanje srčanog ritma nakon uspješne kardioverzije, odnosno uveo novu kontraindikaciju za bolesnike s permanentnom fibrilacijom atrija. Pod nadzorom HALMED-a, u sažetak opisa svojstava lijeka Multaq uključena su nova ograničenja pri primjeni ovog lijeka te nove kontraindikacije i upozorenja, a zdravstvenim radnicima upućeno je pismo o svim navedenim izmjenama i novim preporukama za primjenu lijeka Multaq.
Liječnicima su dane upute da liječenje Multaqom treba ograničiti na bolesnike s paroksizmalnom ili perzistentnom fibrilacijom atrija nakon što je uspostavljen sinusni ritam te da se Multaq više ne smije davati bolesnicima s permanentnom fibrilacijom atrija. Također, Multaq se ne smije davati bolesnicima koji su imali nuspojave oštećenja jetre ili pluća uzrokovanih amiodaronom. Potrebno je redovito nadzirati parametre funkcije pluća i jetre, te srčanog ritma kod bolesnika liječenih Multaqom, a jetrena funkcija treba biti pomno praćena tijekom prvih nekoliko tjedana liječenja Multaqom.
Ocijenjeno je da korist primjene Multaqa i dalje nadilazi rizik primjene kod bolesnika s ne-permanentnom fibrilacijom atrija, odnosno paroksizmalnom ili perzistentnom fibrilacijom atrija, uz određene mjere minimalizacije rizika koje uključuju izmjene u podacima o lijeku namijenjenima propisivačima i bolesnicima, prvenstveno s ciljem umanjivanja rizika od oštećenja jetre, pluća i srca. Na temelju ocjene sigurnosnog profila, preporučuje se propisivati Multaq samo nakon razmatranja drugih mogućnosti liječenja.
Tijekom 2011. godine, pod nadzorom HALMED-a, poslana su ukupno tri pisma zdravstvenim radnicima o novim sigurnosnim informacijama o lijeku Multaq te su objavljene četiri sigurnosne obavijesti na internetskim stranicama HALMED-a.
2.9. Dasatinib
Pod nadzorom HALMED-a, upućeno je pismo zdravstvenim radnicima o mogućem riziku prekapilarne plućne arterijske hipertenzije (PAH) povezane s primjenom dasatiniba (lijek Sprycel). Donesene su preporuke liječnicima za postupanje s bolesnicima koji se liječe dasatinibom kako bi se smanjio rizik za razvoj PAH-a te je od nositelja odobrenja zatraženo uvrštavanje novih sigurnosnih informacija u Sažetak opisa svojstava lijeka za lijek Sprycel.
Dasatinib je inhibitor protein-kinaze koji je indiciran u liječenju odraslih bolesnika s kroničnom mijeloičnom leukemijom (KML) koji ne podnose imatinib mesilat ili imaju bolest otpornu na taj lijek te u liječenju odraslih bolesnika s akutnom limfocitnom leukemijom (ALL) s pozitivnim Philadelphia kromosomom (Ph+) i limfoidnom blastnom KML koji nisu podnosili prethodnu terapiju ili u kojih se bolest pokazala otpornom na prethodno liječenje.





