Izvješće o nuspojavama u 2015. godini
- 1. Uvod
- 2. Prijave sumnji na nuspojave u 2015. godini
- 2.1. Izvori prijava i načini prijavljivanja
- 2.1.1. Izvori prijava
- 2.1.2. Načini prijavljivanja
- 2.2. Karakteristike prijava sumnji na nuspojave
- 2.2.1. Klasifikacija lijekova
- 2.2.2. Dob i spol bolesnika
- 2.2.3. Vrste nuspojava
- 2.2.4. Broj lijekova u istodobnoj primjeni
- 2.2.5. Ozbiljnost nuspojave
- 2.2.6. Ishod nuspojave
- 2.2.7. Nuspojave po organskim sustavima
- 2.2.8. Najčešće prijavljene nuspojave u 2015. godini
- 3. Pregled sigurnosnih pitanja u 2015. godini
- 3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2015. godini
- 3.1.1. Lijekovi koji sadrže mikofenolatnu kiselinu
- 3.1.2. Lijekovi koji sadrže SGLT2 inhibitore
- 3.1.3. Lijekovi koji sadrže visoke doze ibuprofena ili deksibuprofena
- 3.1.4. Lijekovi koji sadrže ambroksol ili bromheksin
- 3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2015. godini
- 3.2.1. HALMED među deset najuspješnijih na svijetu prema broju prijava sumnji na nuspojave na milijun stanovnika
- 3.2.2. Redizajniran portal HALMED-a
- 3.2.3. Inventivni načini promoviranja važnosti pravilne primjene lijekova i prijavljivanja sumnji na nuspojave
1. Uvod
Na temelju Zakona o lijekovima (Narode novine, br. 73/13., 90/14.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 83/13.) Agencija za lijekove i medicinske proizvode - HALMED (u daljnjem tekstu HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave nuspojava lijekova od pacijenata. HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je jedanaesto (11.) izvješće o prijavama nuspojava zaprimljenima iz Republike Hrvatske koje je izradio HALMED.
2. Prijave sumnji na nuspojave u 2015. godini
Tijekom 2015. godine HALMED je zaprimio ukupno 3519 prijava sumnji na nuspojave u Republici Hrvatskoj.
Ukupan broj prijava sumnji na nuspojave u 2015. godini u Republici Hrvatskoj čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave sumnji na nuspojave izravno prijavljene HALMED-u od strane zdravstvenih radnika
- prijave sumnji na nuspojave izravno prijavljene HALMED-u od strane pacijenata/korisnika lijeka
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje lijeka u promet koji su ih zaprimili od zdravstvenih radnika ili pacijenata
- spontanih prijava sumnji na nuspojave cjepiva zaprimljenih u HALMED-u:
-
- prijave sumnji na nuspojave cjepiva koje je zaprimio Hrvatski zavod za javno zdravstvo (HZJZ) i proslijedio HALMED-u
- prijave sumnji na nuspojave cjepiva koje je HALMED izravno primio od zdravstvenih radnika, nositelja odobrenja ili pacijenata
- objavljenih literaturnih podataka o nuspojavama zabilježenima u RH
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj te prijava sumnji na nuspojave iz postmarketinških neintervencijskih ispitivanja
- prijava sumnji na nuspojave dodataka prehrani
- prijava sumnji na nuspojave kozmetičkih proizvoda.
Broj prijava iz svake od navedenih skupina prikazan je u Tablici 1, a njihov udio na Slici 1. Budući da dodaci prehrani i kozmetički proizvodi nisu u nadležnosti HALMED-a, zaprimljene prijave za predmetne proizvode su nakon upisa u bazu nuspojava proslijeđene nadležnim tijelima za praćenje sigurnosti njihove primjene.
Tablica 1. Prijave sumnji na nuspojave po skupinama
| Skupine | Lijekovi | Cjepiva | Dodaci prehrani* | Kozmetički proizvodi* | Nuspojave iz ispitivanja** | UKUPNO |
|---|---|---|---|---|---|---|
| Broj prijava | 3158 | 162 | 17 | 3 | 179 | 3519 |
* skupina proizvoda nije u nadležnosti HALMED-a
** odnosi se na prijave sumnji na ozbiljne neočekivane nuspojave (SUSAR) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj i prijave sumnji na nuspojave iz postmarketinških neintervencijskih ispitivanja
Slika 1. Udio prijava sumnji na nuspojave po skupinama
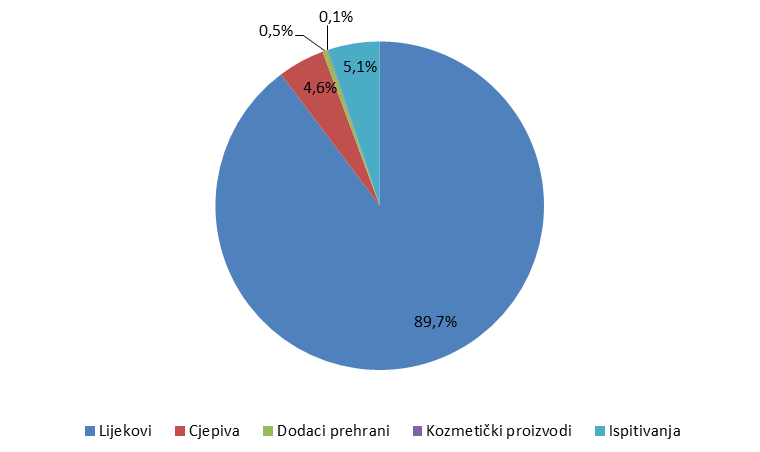
Tijekom 2015. godine HALMED je zaprimio ukupno 3519 prijava sumnji na nuspojave u Republici Hrvatskoj. Od tog broja, 81 prijava prikupljena je iz objavljenih literaturnih podataka o nuspojavama zabilježenima u RH, 179 prijava je proizašlo iz kliničkih ispitivanja ili postmarketinških neintervencijskih ispitivanja, dok je 3259 prijava prikupljeno spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika i pacijenata/korisnika lijeka, koje je HALMED zaprimio izravno odnosno koje su mu proslijeđene od strane nositelja odobrenja za stavljanje lijeka u promet i Hrvatskog zavoda za javno zdravstvo.
Ključni zaključci razmatranja dobivenih podataka su sljedeći:
- Ukupni broj prijava sumnji na nuspojave porastao je za 13% u odnosu na 2014. godinu (3519 prijava u 2015. godini u odnosu na 3112 prijava u 2014. godini), što govori u prilog jačanju svijesti o važnosti prijavljivanja sumnji na nuspojave te praćenja sigurnosti primjene lijekova.
- Više od polovine (50,6%) ukupnog broja prijava zaprimljenih u 2015. godini uputili su liječnici. Iako je u ovoj skupini prijavitelja ostvaren rast od 116 prijava u odnosu na 2014. godinu, smanjen je njihov udio u ukupnom broju prijava zbog porasta broja prijava iz drugih izvora. No, unatoč tome što je udio liječnika koji su u 2015. godini prijavili sumnje na nuspojave najniži do sada, liječnici i dalje čine najzastupljeniju skupinu prijavitelja.
- Udio ljekarnika u prijavama sumnji na nuspojave u 2015. godini iznosio je 36,9%, što je gotovo jednako udjelu iz 2014. godine (37%).
- Broj prijava zaprimljenih od pacijenata/korisnika lijeka kontinuirano raste. U 2015. godini broj prijava zaprimljenih od pacijenata/korisnika lijeka iznosio je 261, što čini 7,4% ukupnog broja svih prijava te predstavlja porast od 39,6% u odnosu na 2014. godinu. Putem nositelja odobrenja HALMED-u je proslijeđeno 137 takvih prijava, dok su u ostala 124 slučaja prijavitelji sumnju na nuspojavu prijavili izravno HALMED-u. Ovaj podatak govori u prilog tome da su javna edukativna kampanja koju je HALMED proveo među pacijentima i korisnicima lijekova u 2013. godini u svrhu promicanja važnosti prijavljivanja nuspojava, kao i niz drugih aktivnosti provedenih s ovom namjenom, ostvarili trajniji utjecaj na prijavljivanje od strane pacijenata.
- Udio prijava zaprimljenih od nositelja odobrenja za stavljanje lijeka u promet u 2015. godini iznosio je 34,5%, što predstavlja značajan porast u odnosu na 2014. godinu, kada je taj udio iznosio 23,4%.
- Udio prijava koje ne ispunjavaju niti jedan od kriterija prema kojima se nuspojava smatra ozbiljnom (72%) značajno je veći od udjela prijava koji takve kriterije ispunjavaju (28%). Ovi podaci u skladu su s podacima iz 2014. godine, kada 71% prijava nije bilo ozbiljno, dok je njih 29% bilo ozbiljno. Potrebno je naglasiti kako ne-ozbiljne nuspojave ne znače automatski i nuspojave koje nisu teške jer i ove nuspojave mogu negativno utjecati na provođenje svakodnevnih aktivnosti pacijenata/korisnika lijeka te smanjiti kvalitetu njihova života. Prijavljivanjem ne-ozbiljnih nuspojava pridonosi se boljem razumijevanju utjecaja nuspojava na kvalitetu života pojedinih pacijenata/korisnika lijeka.
- Ukupno 56% prijava sumnji na nuspojave u 2015. godini zaprimljeno je putem pošte, faksa ili elektroničke pošte. Kako bi proces prijavljivanja i obrade sumnji na nuspojave bio što jednostavniji, HALMED upućuje prijavitelje na prijavljivanje putem on-line aplikacije. Iako je on-line aplikacija namijenjena prvenstveno pacijentima/korisnicima lijeka, preporučuje se da je koriste i zdravstveni radnici, do završetka on-line sustava za prijavljivanje namijenjenog zdravstvenim radnicima, čiji je razvoj u tijeku.
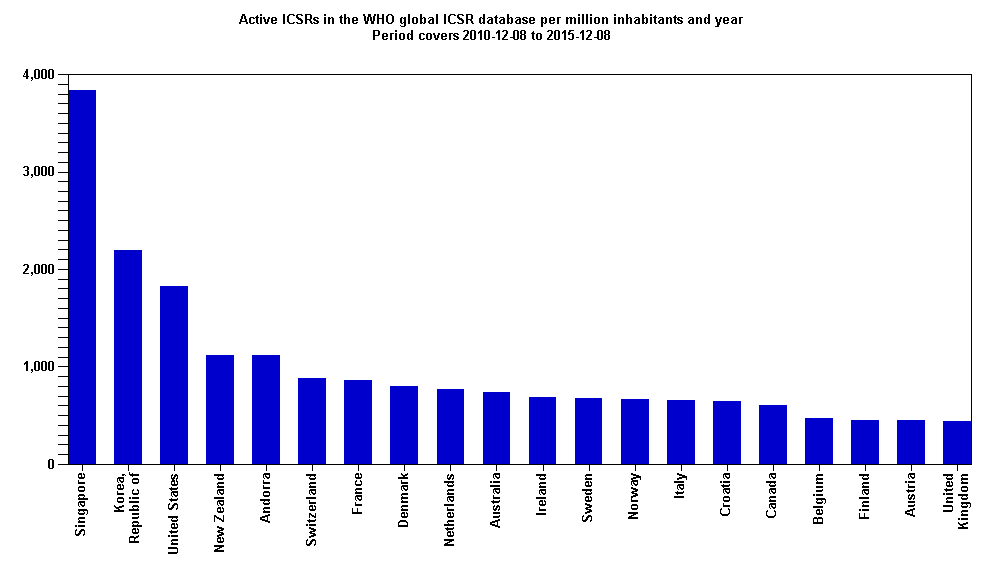
Republika Hrvatska se prema kvaliteti i broju prijava sumnji na nuspojave, izraženo na milijun stanovnika, za razdoblje od 8. prosinca 2010. godine do 8. prosinca 2015. godine pozicionirala na 15. mjesto od 115 zemalja svijeta koje sudjeluju u programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO). Ljestvica prvih dvadeset zemalja svijeta prema broju prijava sumnji na nuspojave na milijun stanovnika u bazi Svjetske zdravstvene organizacije prikazana je na slici 2., preuzetoj s internetske stranice Uppsala Monitoring Centra (UMC), suradnog centra WHO-a za praćenje nuspojava.
Slika 2. Broj prijava sumnji na nuspojave na milijun stanovnika u bazi Svjetske zdravstvene organizacije (UMC - VigiBase), za razdoblje od 8. prosinca 2010. godine do 8. prosinca 2015. godine
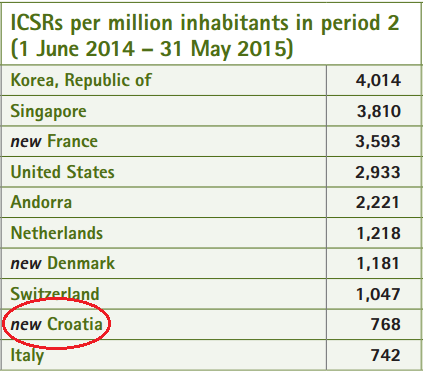
Prema podacima UMC-a iz srpnja 2015. godine, Republika Hrvatska se za razdoblje od 1. lipnja 2014. godine do 31. svibnja 2015. godine uvrstila u prvih deset zemalja u svijetu prema broju zaprimljenih prijava sumnji na nuspojave lijekova na milijun stanovnika. Navedeno je vidljivo iz slike 3., preuzete iz časopisa Uppsala Reports.
Slika 3. Broj prijava sumnji na nuspojave na milijun stanovnika u bazi Svjetske zdravstvene organizacije (UMC - VigiBase), za razdoblje od 1. lipnja 2014. godine do 31. svibnja 2015. godine
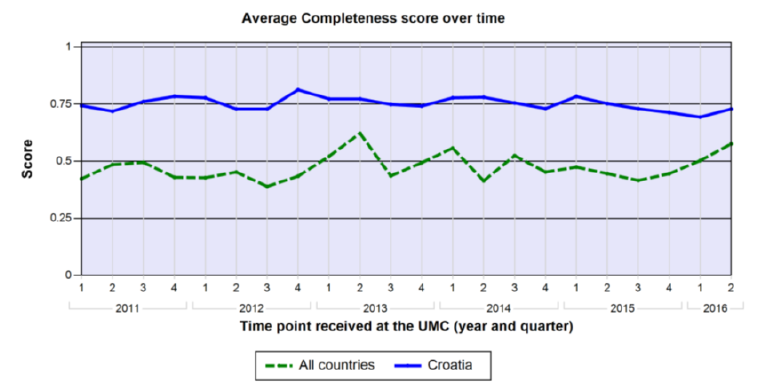
Prema podacima UMC-a iz lipnja 2016. godine, Republika Hrvatska je i u 2015. godini zadržala iznadprosječnu kvalitetu prijava (mjereno vigiGrade Completeness scoreom - sustavom kojim se mjeri količina podataka u pojedinačnoj prijavi) u usporedbi s prosječnim rezultatom svih zemalja koje sudjeluju u programu praćenja sigurnosti lijekova WHO-a. Iz slike 4. može se vidjeti da je kvaliteta prijava u Republici Hrvatskoj posljednjih nekoliko godina kontinuirano veća u odnosu na prosjek svih zemalja.
Ova postignuća rezultat su zajedničkih napora HALMED-a i svih zdravstvenih radnika, pacijenata/korisnika lijeka i nositelja odobrenja za stavljanje lijeka u promet koji redovito prijavljuju sumnje na nuspojave. Veći broj prijava indikator je kvalitete sustava prijavljivanja te svaka dodatna prijava znači dodatnu informaciju o lijeku za pacijente/korisnike lijeka i zdravstvene radnike, što u konačnici dovodi do sigurnije primjene lijekova.
Slika 4. Prosječni rezultat Republike Hrvatske u odnosu na prosječni rezultat svih zemalja koje sudjeluju u programu praćenja sigurnosti lijekova WHO-a prema kvaliteti prijava (prema WHO-UMC)
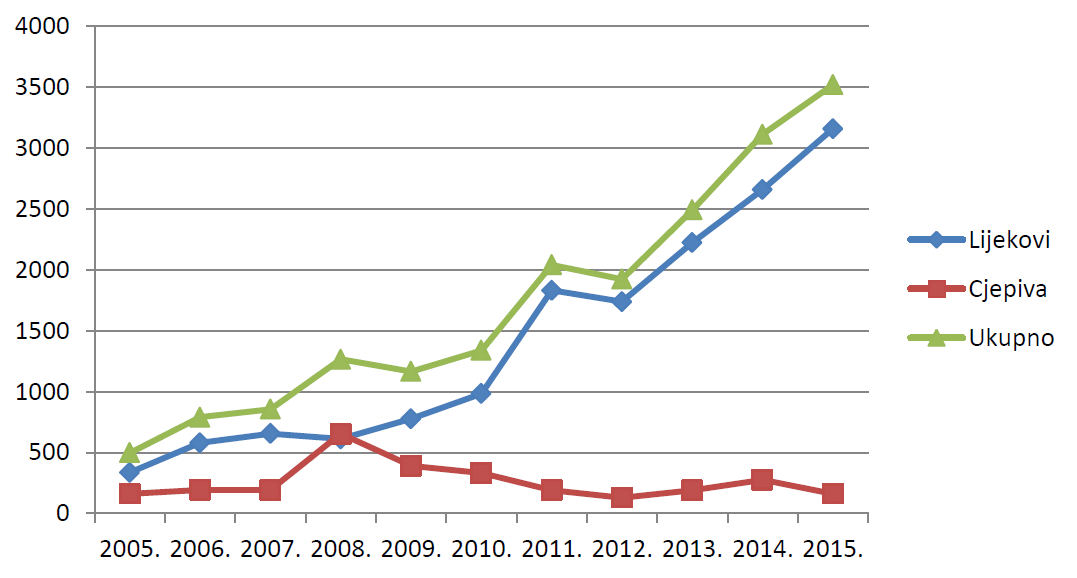
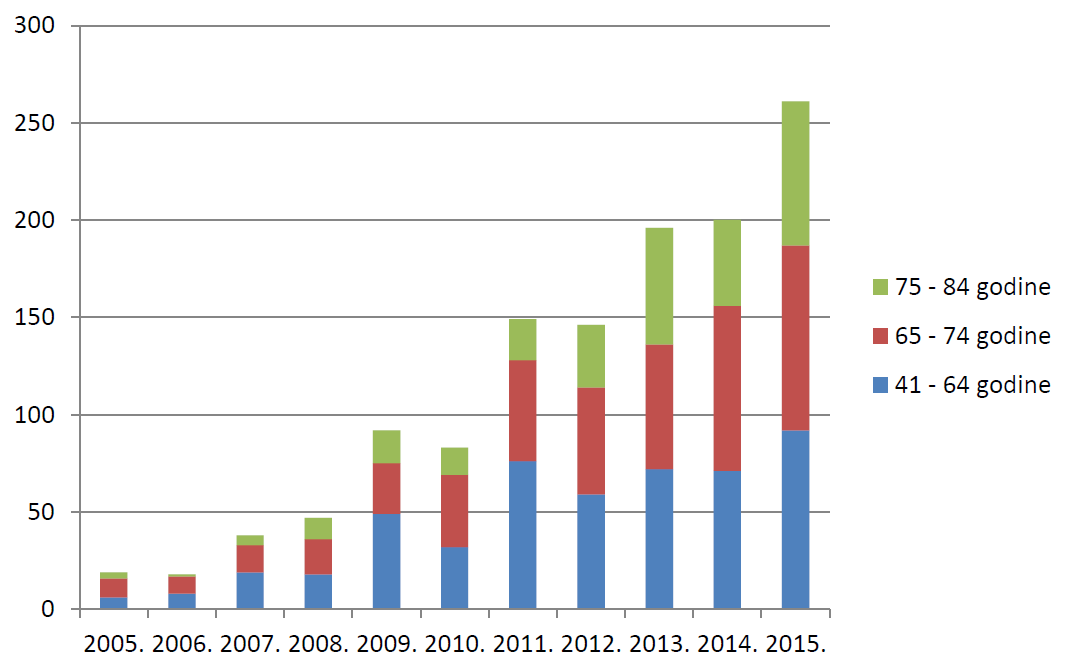
U nastavku je prikazano kretanje ukupnog broja prijava sumnji na nuspojave u razdoblju od 2005. do 2015. godine (tablica 2.) te broja spontanih prijava sumnji na nuspojave lijekova i cjepiva u Republici Hrvatskoj u istome razdoblju (tablica 3.). Dodatno, pripremljen je i usporedni prikaz ukupnog broja prijava sumnji na nuspojave te prijava sumnji na nuspojave lijekova i cjepiva (slika 5.).
Tablica 2. Kretanje ukupnog broja prijava sumnji na nuspojave u Republici Hrvatskoj u posljednjih jedanaest godina (2005. - 2015.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. | 2013. | 2014. | 2015. |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Broj prijava |
498 | 790 | 856 | 1265 | 1165 | 1338 | 2040 | 1923 | 2491 | 3112 | 3519 |
Tablica 3. Kretanje broja spontanih prijava sumnji na nuspojave lijekova i cjepiva u Republici Hrvatskoj u posljednjih jedanaest godina (2005. - 2015.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. | 2013. | 2014. | 2015. |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Lijekovi | 336 | 579 | 655 | 611 | 776 | 983 | 1831 | 1737 | 2223 | 2658 | 3158 |
| Cjepiva | 162 | 194 | 192 | 654 | 389 | 331 | 191 | 129 | 189 | 276 | 162 |
Slika 5. Kretanje broja prijava sumnji na nuspojave u Republici Hrvatskoj u posljednjih jedanaest godina (2005. - 2015.)
U 2015. godini HALMED je nastavio održavati radionice za studente farmacije i medicine, zdravstvene radnike, odgovorne osobe za farmakovigilanciju nositelja odobrenja te pacijente/korisnike lijeka kojima ih se educiralo o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj te o načinu i značaju prijavljivanja sumnji na nuspojave. U 2015. godini održana su sljedeća predavanja i radionice:
- Dana 6. veljače i 6. ožujka 2015. godine organizaciji HALMED- održane su radionice o regulativi lijekova, na kojima su djelatnici HALMED-a predstavili regulatorni okvir u farmakovigilanciji.
- Od 26. do 30. travnja 2015. godine u sklopu izbornog predmeta Farmakovigilancija na poslijediplomskim specijalističkim studijima "Klinička farmacija" i "Razvoj lijekova" na Farmaceutsko-biokemijskom fakultetu Sveučilišta u Zagrebu održana su predavanja kojima su djelatnici HALMED-a upoznavali studente s konceptom mjera minimizacije rizika, primjerima mjera minimizacije rizika te različitim tipovima edukacijskih materijala.
- U organizaciji Hrvatskog farmaceutskog društva u suradnji s HALMED-om i Farmaceutsko-biokemijskim fakultetom Sveučilišta u Zagrebu od 21. do 24. svibnja 2015. godine u Rovinju je održan Peti hrvatski kongres farmacije s međunarodnim sudjelovanjem, na kojem su djelatnici HALMED-a sudjelovali s predavanjima i posterima o novostima na području regulative lijekova i farmakovigilancije.
- Na 2. kongresu farmaceuta Crne Gore s međunarodnim sudjelovanjem, koji je održan od 28. do 31. svibnja 2015. godine u Crnoj Gori, djelatnici HALMED-a održali su predavanje o suradnji između ustanova na području prijavljivanja sumnji na nuspojave u Republici Hrvatskoj.
- U sklopu simpozija "Alergijske reakcije na lijekove s tečajem zbrinjavanja anafilaksije", koji je u organizaciji Referentnog centra Ministarstva zdravlja za alergologiju KB "Sveti Duh" i Hrvatskog društva za alergologiju i kliničku imunologiju HLZ-a održan 24. listopada 2015. godine u Zagrebu, predstavnik HALMED-a održao je predavanje pod nazivom "Rizik pojave medikamentozne alergije u ordinaciji svakog zdravstvenog profesionalca - važnost prijavljivanja sumnji na nuspojave".
- HALMED je dana 12. studenog 2015. godine organizirao dvije radionice u sklopu nastave na integriranom preddiplomskom i diplomskom studiju Farmaceutsko-biokemijskog fakulteta Sveučilišta u Zagrebu o važnosti prijavljivanja sumnji na nuspojave s prikazima slučajeva iz prakse.
- U sklopu programa specijalizacije iz kliničke farmacije i specijalizacije iz kliničke farmakologije specijalizanti u HALMED-u stječu naobrazbu iz farmakovigilancije. U 2015. godini ukupno deset specijalizanata je u sklopu svog programa boravilo u HALMED-u, gdje su educirani i upoznati sa svim područjima farmakovigilancije.
2.1. Izvori prijava i načini prijavljivanja
Od ukupnog broja prijava sumnji na nuspojave koje je HALMED zaprimio u 2015. godini, 1781 prijava zaprimljena je od liječnika, što je činilo udio od 50,6% ukupnog broja zaprimljenih prijava. Navedeni podaci podupiru činjenicu utvrđenu posljednjih godina prema kojoj su liječnici tradicionalno najzastupljenija skupina prijavitelja. U ovoj skupini prijavitelja ostvaren je rast od 116 prijava u odnosu na 2014. godinu, no zabilježen je blagi pad relativnog broja prijava u odnosu na 2014. godinu, kada je ukupno 53,5% prijava zaprimljeno od liječnika. Drugim riječima, smanjen je udio prijava liječnika u ukupnom broju prijava uslijed porasta broja prijava iz drugih izvora.
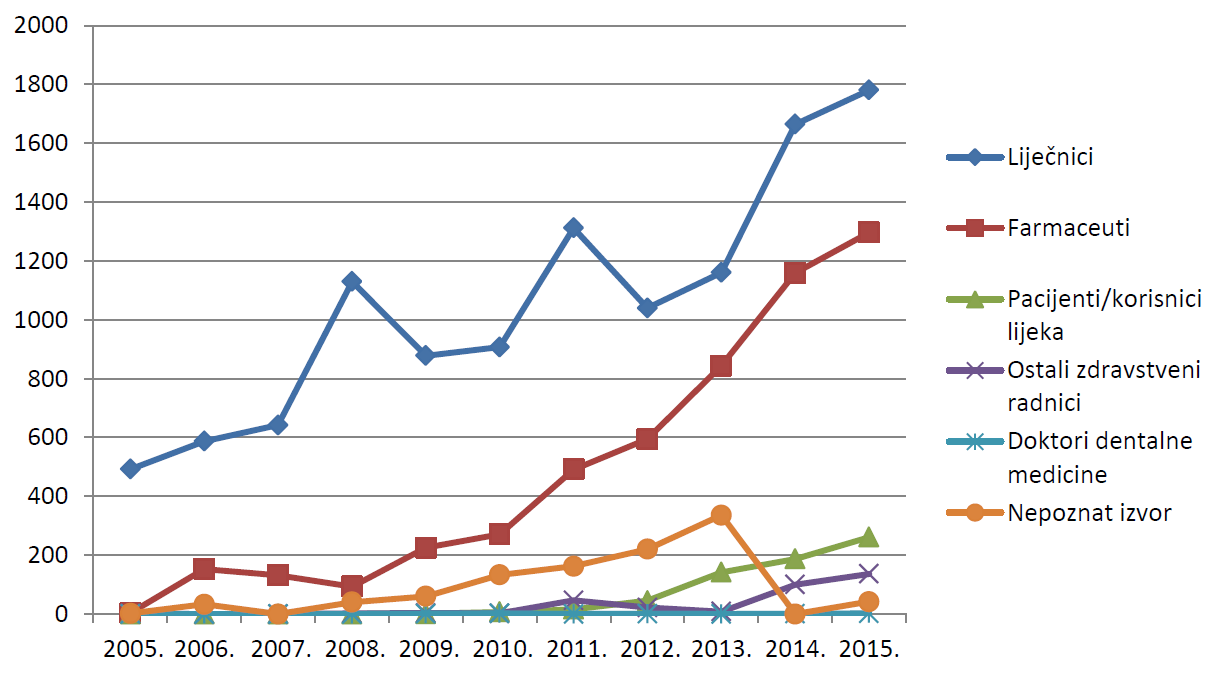
Broj prijava od strane ljekarnika u 2015. godini iznosio je 1297, što čini udio od 36,9% ukupnog broja zaprimljenih prijava. Ovaj broj u skladu je s 2014. godinom, kada je od strane ljekarnika također zaprimljeno prijava u gotovo jednakom udjelu od 37% prijava. Na slici 7. prikazana je usporedba udjela prijava zdravstvenih radnika prema struci prijavitelja u posljednih 11 godina (2005. - 2015.).
U 2015. godini HALMED je zaprimio 261 prijavu od pacijenata/korisnika lijeka ili njihovih zakonskih zastupnika, što čini udio od 7,4% ukupnog broja zaprimljenih prijava (tablica 4.). Broj prijava od pacijenata/korisnika lijeka kontinuirano raste, što se očituje porastom od 39,6% odnosu na 2014. godinu, kada je bilo zaprimljeno 187 prijava. Pokazuje se kako je javno edukativna kampanja koju je HALMED na nacionalnoj razini proveo tijekom rujna i listopada 2013. godine u svrhu promicanja važnosti čitanja upute o lijeku i prijavljivanja sumnji na nuspojave ostvarila dugotrajniji utjecaj na prijavljivanje od strane pacijenata/korisnika lijeka.
Tablica 4. Izvori prijava sumnji na nuspojave u 2015. godini prema struci prijavitelja
| Izvor prijave | Broj prijava |
|---|---|
| Liječnici (bez specijalizacije ili specijalizacija nije navedena) | 1322 |
| Liječnici specijalisti (ukupno) | 459 |
| Specijalist obiteljske/opće medicine | 125 |
| Pedijatar | 66 |
| Internist | 43 |
| Specijalist školske medicine | 30 |
| Transfuziolog | 29 |
| Neurolog | 24 |
| Epidemiolog | 15 |
| Otorinolaringolog | 14 |
| Psihijatar | 13 |
| Radiolog | 13 |
| Onkolog | 13 |
| Klinički farmakolog | 12 |
| Kirurg | 9 |
| Hematolog | 8 |
| Dermatovenerolog | 7 |
| Infektolog | 5 |
| Pulmolog | 5 |
| Reumatolog | 4 |
| Anesteziolog | 4 |
| Fizijatar | 4 |
| Ginekolog | 2 |
| Endokrinolog | 2 |
| Gastroenterolog | 2 |
| Kardiolog | 2 |
| Nefrolog | 1 |
| Oftalmolog | 1 |
| Internistički onkolog | 1 |
| Neurokirurg | 1 |
| Medicina rada | 1 |
| Specijalist hitne medicine | 1 |
| Klinički imunolog | 1 |
| Urolog | 1 |
| Farmaceuti | 1297 |
| Doktori dentalne medicine | 2 |
| Ostali zdravstveni radnici | 136 |
| Nepoznat izvor | 42 |
| Pacijenti | 261 |
| UKUPNO | 3519 |
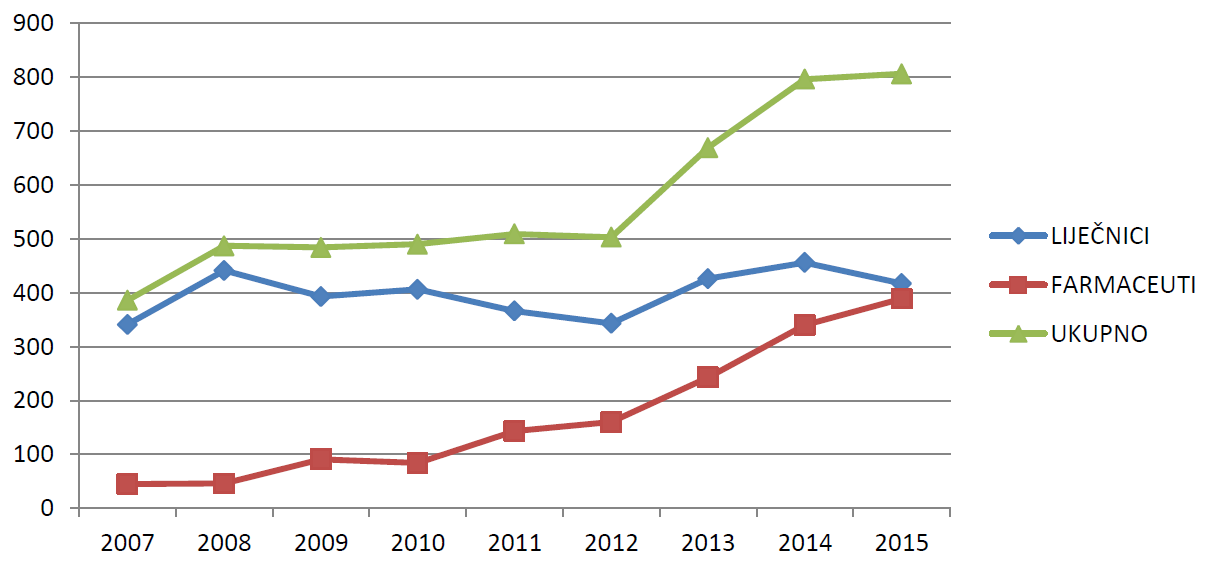
Slika 6. prikazuje kretanje ukupnog broja prijavitelja - liječnika i farmaceuta u razdoblju od 2007. do 2015. godine. U razdoblju od 2012. do 2014. godine zabilježen je značajan porast broja prijavitelja - liječnika i farmaceuta. U 2015. godini broj prijavitelja iznosio je 806, što u odnosu na 2014. godinu čini porast od 10 prijavitelja. Ovaj porast rezultat je prije svega porasta broja pojedinačnih prijavitelja - farmaceuta, koji kontinuirano značajno raste u posljednje četiri godine.
Na temelju navedenih podataka moguće je zaključiti kako postoji određeni broj stalnih prijavitelja - liječnika i farmaceuta, koji se u posljednje dvije godine kreće oko 800. Budući da je broj zdravstvenih radnika - liječnika i farmaceuta u Republici Hrvatskoj značajno veći, potrebno je uložiti dodatne napore kako bi se broj prijavitelja povećao. HALMED će stoga nastaviti s održavanjem radionica o važnosti prijavljivanja sumnji na nuspojave i ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske. Prostor za povećanje broja prijavitelja uočava se posebice na području dentalne medicine, s obzirom na to da su u 2015. godini tek dva doktora dentalne medicine prijavila sumnje na nuspojavu.
Slika 6. Kretanje ukupnog broja prijavitelja - liječnika i farmaceuta u razdoblju od 2007. do 2015. godine
Slika 7. Kretanje broja prijava prema prijaviteljima u razdoblju od 2005. do 2015. godine
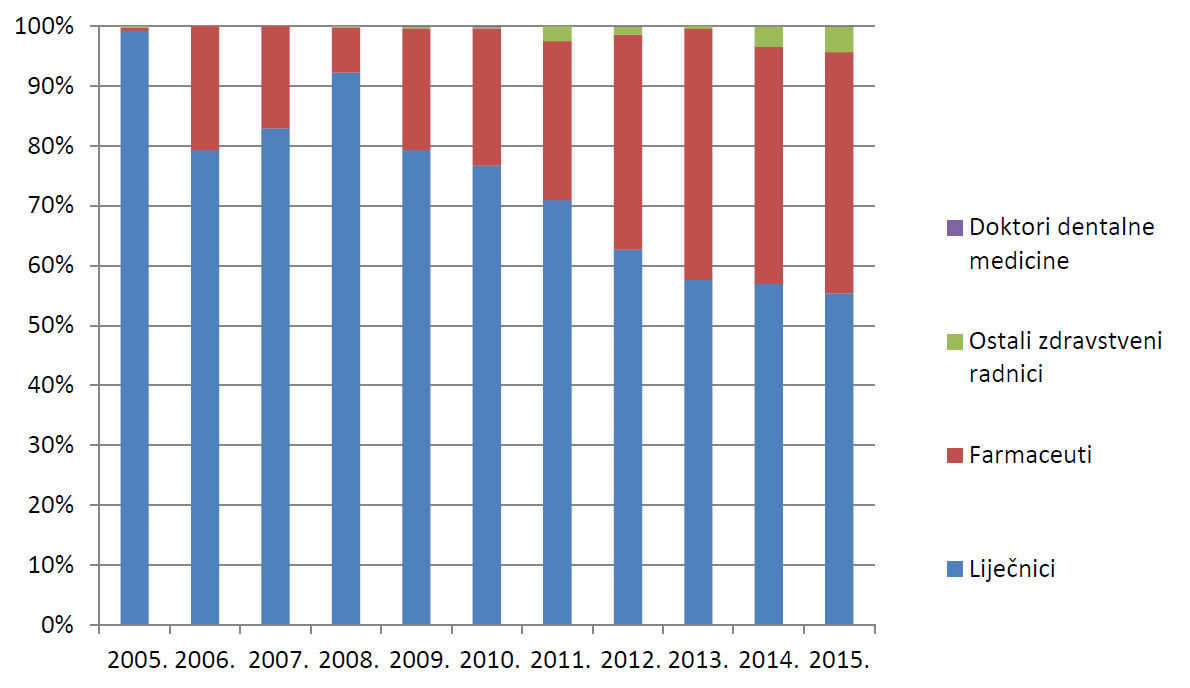
Slika 8. prikazuje udio prijava prema struci prijavitelja - zdravstvenih radnika u razdoblju od 2005. do 2015. godine. Kao što je već prethodno navedeno, u prijavljivanju sumnji na nuspojave tradicionalno dominiraju liječnici, a broj prijava zaprimljenih od farmaceuta kontinuirano raste od 2008. godine.
Slika 8. Udio prijava prema struci prijavitelja - zdravstvenih radnika u razdoblju od 2005. do 2015. godine
Od zdravstvenih radnika u 2015. godini zaprimljeno je 3216 prijava sumnji na nuspojave. Tablica 5. prikazuje broj prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2015. godini.
Tablica 5. Broj prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2015.
| Ustanova | Broj prijava |
|---|---|
| Ljekarna | 1180 |
| Ordinacija obiteljske medicine | 342 |
| Klinička bolnica ili klinički bolnički centar | 225 |
| Opća bolnica | 149 |
| Zavod za javno zdravstvo | 53 |
| Pedijatrijska ordinacija | 38 |
| Specijalna bolnica | 100 |
| Ostalo* | 27 |
| Nepoznato | 1102 |
| UKUPNO PRIJAVA: | 3216 |
*prijave iz ustanova koje nisu obuhvaćene drugim navedenim kriterijima, a koje obuhvaćaju, primjerice, prijave pristigle iz privatnih specijalističkih ordinacija.
Slika 9. prikazuje udio pojedinih zdravstvenih ustanova u broju prijava sumnji na nuspojave zaprimljenih od zdravstvenih radnika u 2015. godini. Kategorijom Primarna zdravstvena zaštita obuhvaćene su prijave zaprimljene iz ordinacija obiteljske i školske medicine, pedijatrijskih ordinacija te ginekoloških, stomatoloških i psihijatrijskih ordinacija. Kategorijom Bolnice obuhvaćene su prijave zaprimljene iz općih i specijalnih bolnica te kliničkih bolnica i kliničkih bolničkih centara. Posebno su navedene kategorije za zavode za javno zdravstvo, koji imaju značajnu ulogu u sustavu prijavljivanja sumnji na nuspojave cjepiva, te ljekarne. Kroz prijave nije identificirano 34% ustanova, što je nešto više u odnosu na 2014. godinu, kada je taj udio iznosio 28%. Navedeni podaci ukazuju na to da je potrebno uložiti dodatne napore s ciljem identificiranja ovih podataka u budućim prijavama te smanjenjem broja prijava pod kategorijom Nepoznato.
Slika 9. Udio pojedinih zdravstvenih ustanova u broju prijava sumnji na nuspojave od zdravstvenih radnika u 2015. godini
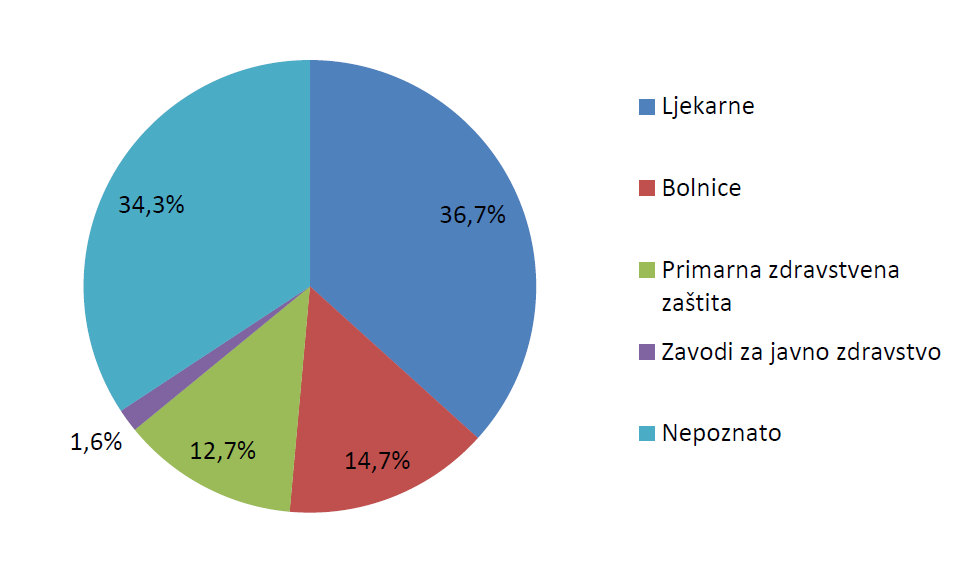
Broj prijava iz bolničkih ustanova u 2015. godini iznosio je 474 (tablica 5.), što je činilo udio od 14,7% ukupnog broja prijava (slika 9.). Budući da za otprilike 1100 prijava nije točno navedena ustanova iz koje je prijava zaprimljena, moguće je da se neke prijave iz bolnica nalaze unutar ovog broja. Udio prijava iz bolničkih ustanova ostao je u skladu s podacima iz 2014. godine, kada je taj udio također iznosio 14%. Budući da taj udio u posljednjih nekoliko godina ne ostvaruje značajniji rast, HALMED smatra kako je potrebno uložiti dodatne radnje kojima će se povećati trenutačni udio prijava iz bolničkih ustanova. Jedno od rješenja uključuje edukaciju zdravstvenih radnika u bolničkim ustanovama kako bi ih se osvijestilo o važnosti prijavljivanja sumnji na nuspojave. Dodatno, HALMED je započeo projekt OPeN s ciljem razvoja on-line sustava prijavljivanja za zdravstvene radnike. U jednoj od faza projekta planirana je integracija on-line sustava prijavljivanja u bolničke informacijske sustave (BIS), čime će se omogućiti jednostavnije prijavljivanje sumnji na nuspojave te, posljedično, povećati broj prijava iz bolničkih ustanova. Povećanje broja prijava dovodi do poboljšanja kvalitete sustava prijavljivanja sumnji na nuspojave, pri čemu su nuspojave iz bolničkih ustanova od osobitog značaja jer mogu dovesti do hospitalizacije i/ili produžiti hospitalizaciju čime uvijek pripadaju kategoriji ozbiljnih nuspojava. Svijest o takvim nuspojavama može pridonijeti sigurnijoj primjeni lijekova te sprječavanju njihova nastanka u budućnosti.
HALMED je i u 2015. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. Najviše prijava zaprimljeno je, kao i 2014. godine, s područja Grada Zagreba - 2075. Osječko-baranjska županija nalazi se na drugom mjestu s 258 prijava, dok se na trećem mjestu nalazi Splitsko-dalmatinska županija sa 191 prijavom.
Tablica 6. Broj prijava po županijama u 2015. godini
| Županija | Ukupni broj prijava u 2015. godini | Broj prijava na 10.000 stanovnika u 2015. godini |
|---|---|---|
| I. Zagrebačka | 97 | 3,1 |
| II. Krapinsko-zagorska | 41 | 3,1 |
| III. Sisačko-moslavačka | 115 | 6,7 |
| IV. Karlovačka | 22 | 1,7 |
| V. Varaždinska | 27 | 1,5 |
| VI. Koprivničko-križevačka | 48 | 4,2 |
| VII. Bjelovarsko-bilogorska | 59 | 4,9 |
| VIII. Primorsko-goranska | 133 | 4,5 |
| IX. Ličko-senjska | 13 | 2,6 |
| X. Virovitičko-podravska | 8 | 0,9 |
| XI. Požeško-slavonska | 3 | 0,4 |
| XII. Brodsko-posavska | 21 | 1,3 |
| XIII. Zadarska | 72 | 4,2 |
| XIV. Osječko-baranjska | 258 | 8,5 |
| XV. Šibensko-kninska | 52 | 4,8 |
| XVI. Vukovarsko-srijemska | 75 | 4,2 |
| XVII. Splitsko-dalmatinska | 191 | 4,2 |
| XVIII. Istarska | 142 | 6,8 |
| XIX. Dubrovačko-neretvanska | 39 | 3,2 |
| XX. Međimurska | 28 | 2,5 |
| XXI. Grad Zagreb | 2075 | 26,3 |
| UKUPNO | 3519 | 8,2 |
Prosječni broj prijava izražen na 10.000 stanovnika za cijelu Republiku Hrvatsku u 2015. godini iznosio je 8,2 prijave. U odnosu na prosjek Republike Hrvatske, Grad Zagreb i Osječko-baranjska županija bilježe iznadprosječni rezultat. Sve ostale županije nalaze se ispod državnog prosjeka. U 9 županija zabilježen je porast, a u preostalih 12 županija pad prosječnog broja prijava izraženog na 10.000 stanovnika.
Razlog značajnog broja prijava zaprimljenih s područja Grada Zagreba moguće je objasniti činjenicom da se sjedišta gotovo svih nositelja odobrenja za stavljanje lijeka u promet nalaze upravo na području Grada Zagreba.
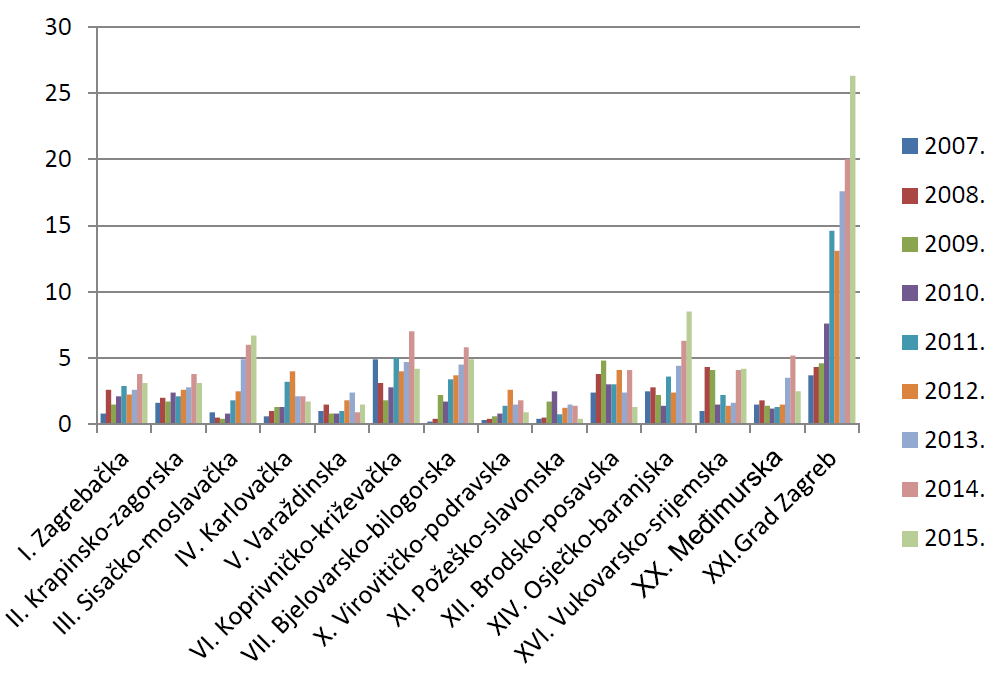
Slika 10. Broj prijava na 10.000 stanovnika po županijama u razdoblju od 2007. do 2015. godine (kontinentalna Hrvatska)
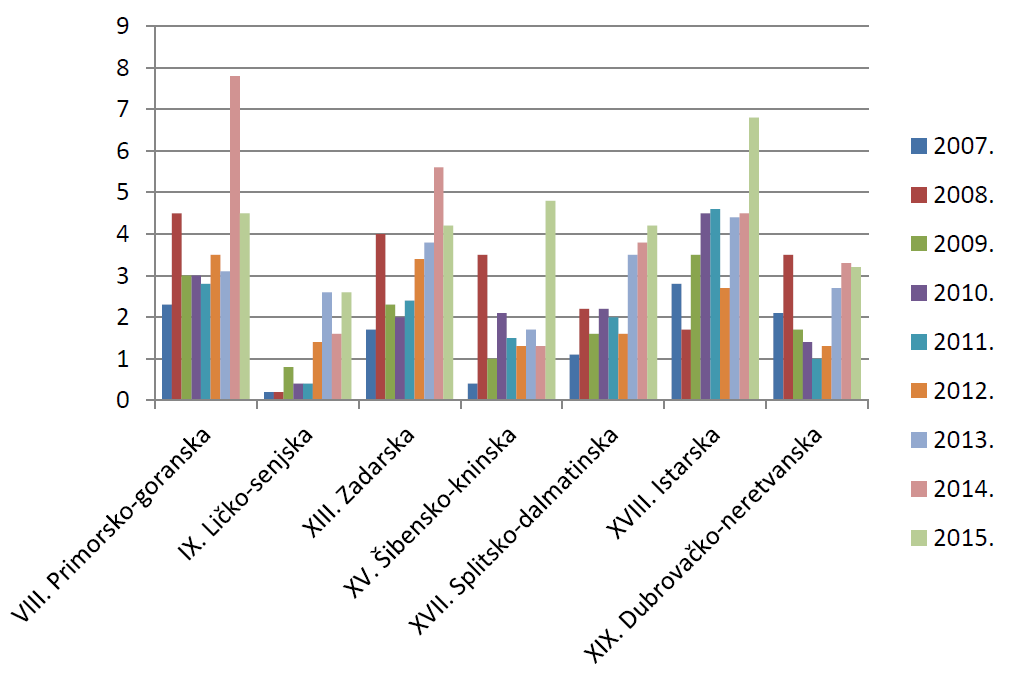
Slika 11. Broj prijava na 10.000 stanovnika po županijama u razdoblju od 2007. do 2015. godine (jadranska Hrvatska)
Prijavljivanje sumnji na nuspojave HALMED-u u 2015. godini bilo je moguće slanjem ispunjenog obrasca HALMED-u poštom ili faksom, putem elektroničke pošte ili korištenjem on-line aplikacije za prijavu nuspojava dostupne na internetskim stranicama HALMED-a. U prikupljanju prijava sumnji na nuspojave sudjeluju i nositelji odobrenja za stavljanje lijeka u promet, koji su sve prijave koje zaprime dužni proslijediti HALMED-u elektronički putem baze EudraVigilance.
Tablica 7. i slika 12. prikazuju ukupan broj i udio zaprimljenih prijava s obzirom na način prijavljivanja.
Tablica 7. Broj prijava prema načinu prijavljivanja
| Način prijavljivanja | Broj prijava |
|---|---|
| EudraVigilance | 1214 |
| Elektronička pošta | 832 |
| Pošta | 627 |
| Faks | 497 |
| On-line aplikacija | 349 |
| UKUPNO | 3519 |
Slika 12. Udio prijava prema načinu prijavljivanja
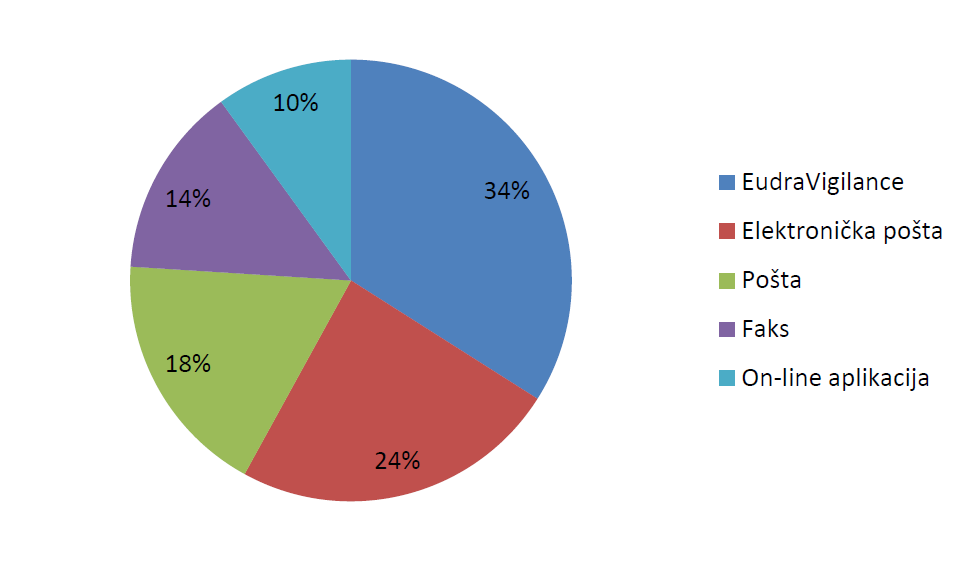
Ukupno 1214 prijava proslijeđeno je HALMED-u od nositelja odobrenja za stavljanje lijeka u promet putem baze EudraVigilance, što čini udio od 34,5% ukupnog broja zaprimljenih prijava u 2015. godini. U odnosu na 2014. godinu, kada su nositelji odobrenja za stavljanje lijeka u promet HALMED-u proslijedili 728 prijava, zabilježen je značajan porast broja prijava od 66,8%.
Tijekom 2015. godine 349 prijava zaprimljeno je putem on-line aplikacije za prijavu nuspojava dostupne na internetskim stranicama HALMED-a. Iako je navedena aplikacija namijenjena prvenstveno pacijentima/korisnicima lijeka, u značajnoj je mjeri koriste i zdravstveni radnici. Od 349 prijava zaprimljenih putem on-line aplikacije, njih 280 pristiglo je od zdravstvenih radnika, dok su 69 prijava poslali pacijenti/korisnici lijeka, članovi obitelji pacijenata/korisnika lijeka ili zakonski zastupnici/skrbnici. Broj prijava zaprimljenih putem on-line aplikacije nije značajnije porastao u odnosu na 2014. godinu, kada je iznosio 335.
Prema podacima iz 2015. godine, više od polovice prijava sumnji na nuspojave (56%) i dalje se zaprima slanjem ispunjenog obrasca putem pošte, faksa ili elektroničke pošte. Takav način prijavljivanja zahtijeva značajno više vremena za obradu i unos u bazu nuspojava, što bi s daljnjim povećanjem broja prijava moglo otežati farmakovigilancijske procese. Korištenjem on-line aplikacije za prijavu nuspojava smanjuje se vrijeme koje je potrebno uložiti prilikom prijave sumnje na nuspojavu i unošenja podataka u bazu nuspojava. Kako bi proces prijavljivanja sumnji na nuspojave bio što jednostavniji, HALMED poziva zdravstvene radnike na korištenje on-line aplikacije, do završetka razvoja on-line sustava za prijavu sumnji na nuspojave koji će biti namijenjen zdravstvenim radnicima.
U svrhu racionalizacije procesa zaprimanja, obrade i prosljeđivanja prijava sumnji na nuspojave, HALMED je u 2015. godini, naime, pokrenuo projekt razvoja on-line sustava za prijavljivanje sumnji na nuspojavu - OPeN. Projekt je podijeljen u više faza, koje uključuju razvoj programske podrške za obradu prijava sumnji na nuspojave za djelatnike HALMED-a te razvoj on-line aplikacije za zdravstvene radnike putem koje će moći prosljeđivati i pratiti svoje prijave sumnji na nuspojave. U kasnijim fazama projekta predviđen je razvoj okruženja koje će omogućiti izravno slanje prijava sumnji na nuspojave iz informatičkih sustava liječnika primarne zdravstvene zaštite, bolničkih informatičkih sustava i ljekarni.
Tijekom 2015. godine HALMED je bio aktivno uključen u projekt Europske komisije pod nazivom Innovative Medicines Initiative WEB-RADR (Recognising Adverse Drug Reactions). Cilj je ovog projekta razviti što jednostavniji i pristupačniji način prijavljivanja sumnji na nuspojave lijekova putem novih kanala i društvenih mreža kako bi se dodatno osnažilo uključivanje pacijenata/korisnika lijeka i zdravstvenih radnika u praćenje sigurnosti primjene lijekova. U sklopu projekta tijekom 2015. godine započet je i razvoj aplikacije za prijavljivanje sumnji na nuspojave lijekova putem mobilnih telefona, koji je u svibnju 2016. godine uspješno završen nakon čega je mobilna aplikacija puštena u rad. U projektu uz HALMED sudjeluju Europska agencija za lijekove (EMA), Agencija za lijekove Ujedinjenog Kraljevstva (MHRA), Uppsala Monitoring Centre (UMC) i Nacionalni centar za praćenje nuspojava Nizozemske (LAREB) te brojni drugi partneri iz redova akademske zajednice, udruga pacijenata/korisnika lijeka i farmaceutske industrije.
2.2. Karakteristike prijava sumnji na nuspojave
Prvi put u posljednjih deset godina najzastupljenija skupina lijekova prema ATK klasifikaciji, odnosno ATK skupina za koju je zaprimljen najveći broj prijava sumnji na nuspojave, je skupina L (lijekovi za liječenje zloćudnih bolesti i imunomodulatori). Na drugom i trećem mjestu nalaze se skupina J (lijekovi za liječenje sustavnih infekcija) i skupina C (lijekovi za liječenje bolesti kardiovaskularnog sustava), koje se u posljednjih nekoliko godina tradicionalno nalaze među najzastupljenijim skupinama. Svrstavanje skupine L kao najzastupljenije prema ATK klasifikaciji lijekova moguće je objasniti činjenicom da se trenutačno provodi nekoliko postmarketinških neintervencijskih ispitivanja s lijekovima iz te skupine te je praćenje sigurnosti njihove primjene dodatno pojačano, što nužno utječe na povećanje broja prijava iz predmetne skupine lijekova.
Ukupan broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava jer je u jednoj prijavi sumnje na nuspojavu moguće navesti više od jednog lijeka pod sumnjom (tablica 8.).
Tablica 8. Broj lijekova za koje je u 2015. godini prijavljena sumnja na nuspojavu prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji
| ATK klasifikacija | 2015. |
|---|---|
| ATK 1. razina A skupina (probavni sustav) | 300 |
| ATK 1. razina B skupina (učinak na krv) | 228 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 647 |
| ATK 1. razina D skupina (dermatici) | 25 |
| ATK 1. razina G skupina (urogenitalni sustav i spolni hormoni) | 132 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 166 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 728 |
| ATK 1. razina L skupina (citostatici) | 912 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 195 |
| ATK 1. razina N skupina (živčani sustav) | 513 |
| ATK 1. razina P skupina (parazitne infekcije) | 3 |
| ATK 1. razina R skupina (respiratorni sustav) | 188 |
| ATK 1. razina S skupina (pripravci za osjetila) | 74 |
| ATK 1. razina V skupina (različito) | 41 |
| UKUPNI BROJ LIJEKOVA | 4152 |
Slika 13. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2015. godine za najzastupljenije skupine lijekova
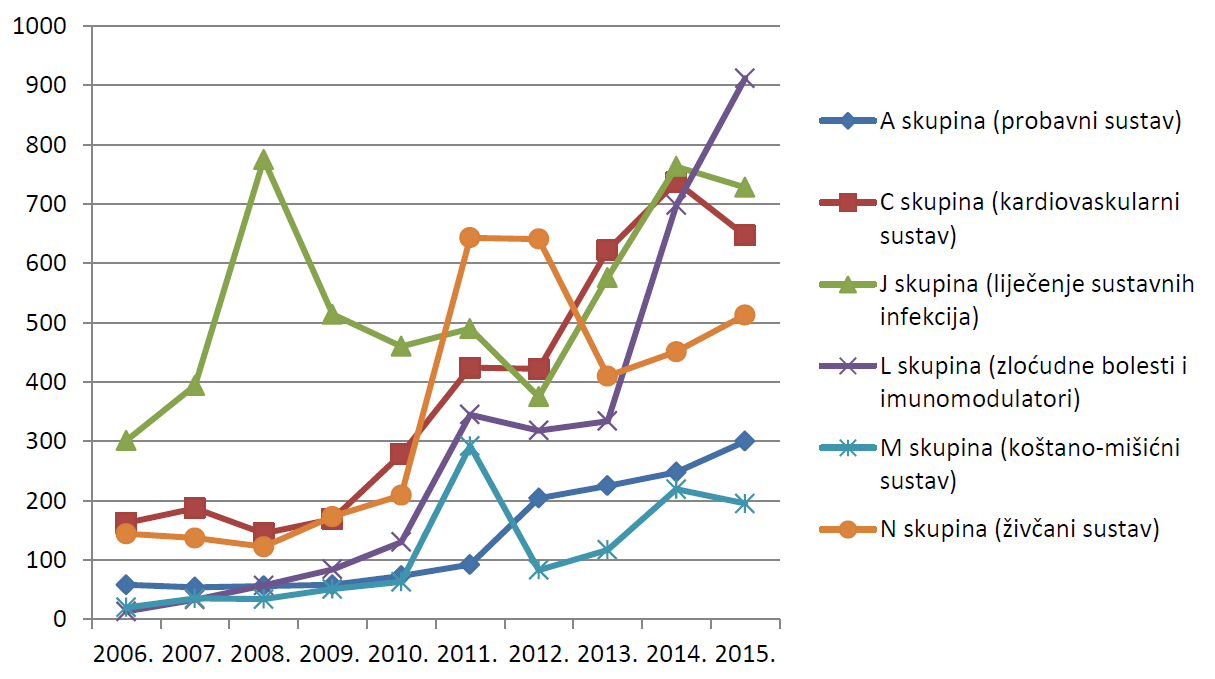
Slika 14. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2015. godine za manje zastupljene skupine lijekova
Tablica 9. Prijave sumnji na nuspojave lijekova prema dobi bolesnika u 2014. godini u usporedbi s 2013. godinom
| Mjesto po broju prijava po ATK skupinama | Liječnici | Farmaceuti | Pacijenti/korisnici lijeka | |||
|---|---|---|---|---|---|---|
| Skupina | Broj prijava | Skupina | Broj prijava | Skupina | Broj prijava | |
| 1. | L | 667 | C | 395 | J | 59 |
| 2. | J | 403 | J | 244 | A | 39 |
| 3. | N | 274 | N | 164 | N | 37 |
Liječnici najčešće prijavljuju nuspojave za lijekove iz ATK skupine L, farmaceuti najčešće prijavljuju nuspojave za lijekove iz ATK skupine C, dok pacijenti/korisnici lijeka najčešće prijavljuju nuspojave za lijekove iz ATK skupine J. Ovi podaci u skladu su s podacima za 2014. godinu. U tri najzastupljene skupine lijekova za čije nuspojave najviše prijava stiže od pacijenata/korisnika lijeka u 2015. godini svrstala se skupina A (lijekovi koji djeluju na probavni sustav i metabolizam).
Tablica 10. prikazuje prijave sumnji na nuspojave prema dobi bolesnika u 2015. godini u usporedbi s 2014. godinom. Broj prijava u 2015. godini u odnosu na 2014. godinu porastao je u svim dobnim skupinama osim u dobnim skupinima djece i adolescenata u dobi od 3 godine do 17 godina, za koje je zabilježen blagi pad broja prijava.
Tablica 10. Prijave sumnji na nuspojave prema dobi bolesnika u 2015. godini u usporedbi s 2014. godinom
| Dob bolesnika | Broj prijava u 2015. godini | Broj prijava u 2014. godini |
|---|---|---|
| Do 12 mjeseci | 57 | 44 |
| 1 do 2 godine | 88 | 65 |
| 3 do 6 godina | 47 | 59 |
| 7 do 14 godina | 83 | 143 |
| 15 do 17 godina | 25 | 30 |
| 18 do 40 godina | 558 | 465 |
| 41 do 64 godine | 1161 | 963 |
| 65 do 74 godina | 628 | 589 |
| 75 do 84 godina | 363 | 304 |
| 85 godina i starije | 56 | 41 |
| Nepoznata dob | 453 | 409 |
| UKUPNO | 3519 | 3112 |
Ukupno gledajući, sumnje na nuspojave u 2015. godini češće su prijavljivane za starije dobne skupine u odnosu na 2014. godinu. Broj prijava iz kojih nije moguće saznati točnu dob pacijenta iznosi približno 13%, što je u skladu s podacima iz 2014. godine. Većina prijava koja ne sadrži podatke o dobi zaprimljena je od strane nositelja odobrenja za stavljanje lijeka u promet, što upućuje na to da je prema njima potrebno usmjeriti dodatne aktivnosti za povećanje kvalitete prijava.
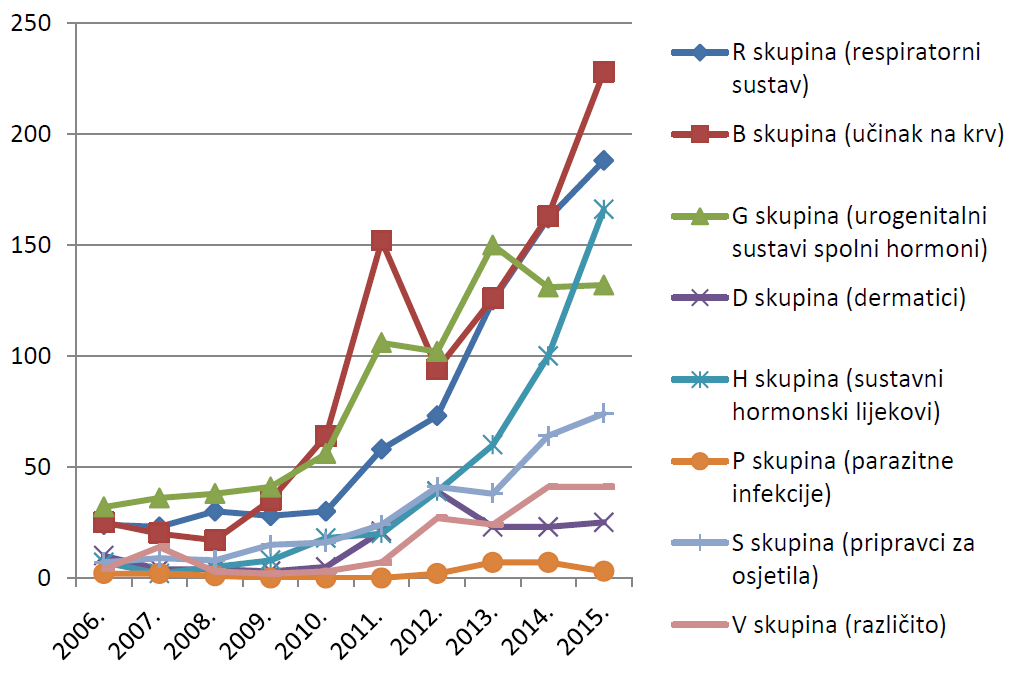
Slika 15. Pregled kretanja broja prijava za mlađe dobne skupine u razdoblju od 2008. do 2015. godine
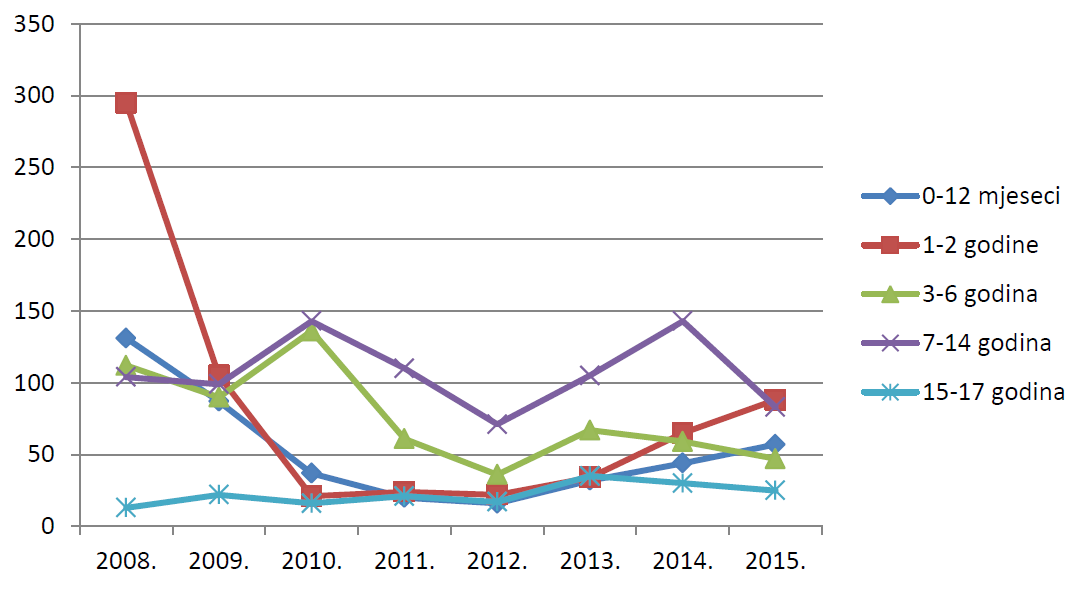
Slika 16. Pregled kretanja broja prijava za osobe u dobi od 18 godina i starije u razdoblju od 2008. do 2015. godine
Tablica 11. Prijave sumnji na nuspojave prema spolu bolesnika u 2015. godini u usporedbi s 2014. godinom
| Spol | Broj prijava u 2015. godini | Broj prijava u 2014. godini | % u 2015. godini | % u 2014. godini |
|---|---|---|---|---|
| Muškarci | 1305 | 1118 | 37 | 36 |
| Žene | 2025 | 1860 | 58 | 60 |
| Nepoznato | 189 | 134 | 5 | 4 |
| UKUPNO | 3519 | 3112 | 100 | 100 |
Slika 17. Prijave sumnji na nuspojave prema spolu bolesnika u 2015. godini
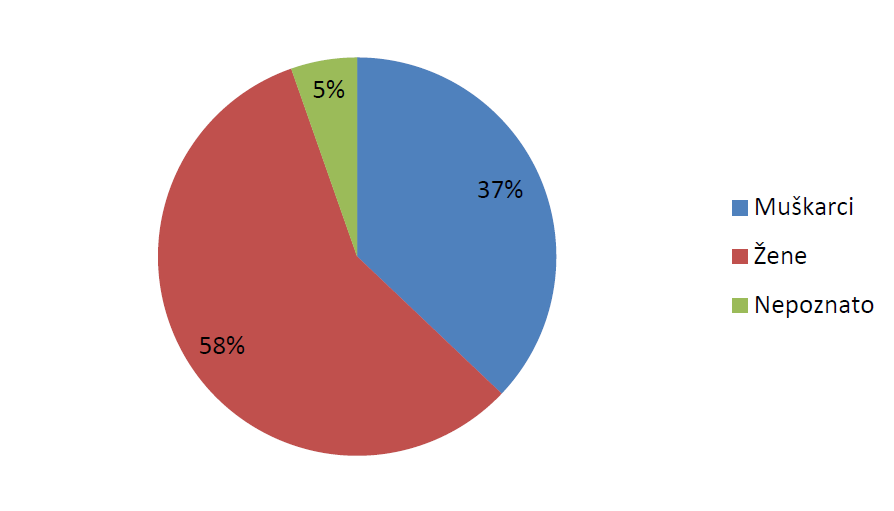
Najveći broj prijava sumnji na nuspojave u 2015. godini zaprimljen je za pacijente/korisnike lijeka ženskog spola (58%), 37% prijava odnosilo se na muške pacijente/korisnike lijeka, dok je broj prijava iz kojih nije moguće saznati spol bolesnika iznosio 5%.
Statistika koju HALMED vodi za prijave sumnji na nuspojave pokazuje kako je već jedanaestu godinu zaredom veći broj prijava sumnji na nuspojave zaprimljen za pacijente/korisnike lijeka ženskog spola.
Nuspojave se prema mehanizmu nastanka osnovno dijele na nuspojave tipa A, koje su posljedica pretjeranoga farmakološkog učinka odnosno koje su povezane s dozom i učestalosti primjene, i nuspojave tipa B, koje uključuju imunoalergijske reakcije, pseudoalergijske reakcije, metaboličku intoleranciju i idiosinkrazije. Od ukupno 9294 prijavljene nuspojave, njih 2640 svrstano je u reakcije tipa B, što čini 28,4% svih nuspojava te je u skladu s podacima za 2014. godinu. U uzorku iz 2015. godine među osobama kod kojih se javljaju nuspojave tipa B dominiraju osobe ženskog spola, kao i u 2014. godini. U 1% prijava spol nije poznat (tablica 13.).
Broj nuspojava tipa F, koje uključuju prijave sumnji na nedjelotvornost lijeka, u 2015. godini iznosio je 1,1% ukupnog broja prijava.
Tablica 12. Vrste prijavljenih nuspojava u 2015. godini u usporedbi s 2014. godinom
| Vrsta nuspojava | Broj nuspojava u 2015. godini | Broj nuspojava u 2014. godini | % nuspojava u 2015. godini | % nuspojava u 2014. godini |
|---|---|---|---|---|
| Tip A | 6552 | 5910 | 70,5 | 72,1 |
| Tip B | 2640 | 2216 | 28,4 | 27,1 |
| Tip F | 102 | 82 | 1,1 | 0,8 |
| UKUPNO | 9294 | 8208 | 100 | 100 |
Tablica 13. Odnos spola i nuspojava tipa B u 2015. godini u usporedbi s 2014. godinom
| Spol | Broj nuspojava tipa B u 2015. godini | Broj nuspojava tipa B u 2014. godini | % u 2015. godini | % u 2014. godini |
|---|---|---|---|---|
| Muškarci | 880 | 598 | 33 | 27 |
| Žene | 1735 | 1551 | 66 | 70 |
| Nepoznato | 25 | 67 | 1 | 3 |
| UKUPNO | 2640 |
2216 | 100 | 100 |
Slika 18. Udio nuspojava tipa B po spolu pacijenta/korisnika lijeka u razdoblju od 2005. do 2015. godine
Kada su u pitanju nuspojave tipa A, koje su posljedica pretjeranoga farmakološkog učinka lijeka, vrijedi istaknuti da su tijekom 2015. godine, kao i prethodnih godina, putem projekta "Farmakogenomika i farmakovigilancija - sprječavanje nuspojava u individualizaciji terapije", u Kliničkoj jedinici za farmakogenomiku i individualizaciju terapije Kliničkog bolničkog centra Zagreb provedene različite farmakogenetičke analize za pacijente/korisnike lijeka koji su razvili nuspojave lijeka prijavljene HALMED-u. HALMED je u 2015. godini zaprimio i obradio ukupno 39 prijava sumnji na nuspojavu s farmakogenetičkim nalazima.
Rezultati farmakogenetičkih analiza koriste se za individualizaciju terapije pojedinačnog pacijenta/korisnika lijeka. Također, koriste se u svrhu rada na području farmakovigilancije, kao i pri otkrivanju novih sigurnosnih signala.
Popis lijekova, nuspojava i farmakogenetičkih biljega analiziranih u sklopu suradnje HALMED-a i KBC-a Zagreb naveden je u tablici 14.
Tablica 14. Popis lijekova, nuspojava i farmakogenetičkih biljega analiziranih u sklopu suradnje HALMED-a i Kliničkog bolničkog centra Zagreb
| Skupina lijekova/ lijek | Nuspojave | Farmakogenetički biljezi |
|---|---|---|
| statini simvastatin atorvastatin |
miotoksičnost, hepatotoksičnost | SLCO1B1, ABCG2, ABCB1, CYP3A4 |
| statini rosuvastatin fluvastatin |
miotoksičnost, hepatotoksičnost | CYP2C9, CYP2C19, SLCO1B1, ABCG2, ABCB1 |
| varfarin | manja i veća krvarenja | CYP2C9, VKORC1, ABCB1 |
| klopidogrel ticagrelor |
manja i veća krvarenja | CYP2C19, CYP3A4, CYP3A5, ABCB1 |
| dabigatran rivaroksaban | manja i veća krvarenja | ABCB1 CYP3A4, CYP3A5 |
| antiepileptici | hepatotoksičnost, tremor, glavobolja, vrtoglavica | CYP2C9, CYP2C19, CYP3A4, UGT2B7, UGT1A4, ABCC2 |
| antipsihotici | akutni ekstrapiramidni simptomi, parkinsonizam, akatizija | CYP2D6, CYP3A4, DAT, D2R |
| imunosupresivi ciklosporin, takrolimus mikofenolna kiselina |
nefrotoksičnost, gastrointestinalna nepodnošljivost, mijelosupresija | CYP3A4, CYP3A5, ABCB1, ABCC2, UGT1A9, UGT2B7 |
| 5-FU, irinotekan | mijelosupresija, proljev, smrt | DPYD, UGT1A1, SLCO1B1 |
| metotreksat | nefrotoksičnost | ABCB1, ABCC2, ABCG2, SLCO1B1 |
| azatioprin | mijelosupresija, simptomi slični gripi, hepatotoksičnost | TPMT, ITPA, XO |
| inhibitori tirozin kinaze | pankreatitis, rabdomioliza, glavobolja, osip, crvenilo i svrbež kože | CYP2D6, CYP2C9, CYP3A4, ABCB1, ABCG2, SLCO1B1 |
| nesteroidni antireumatici | mučnina, gastrointestinalna nepodnošljivost, hepatotoksičnost, manja i veća krvarenja | CYP2C9, CYP2C19, ABCC2, UGT2B7 |
| biološki lijekovi - anti TNF alfa | nedjelotvornost, kožne promjene | SLCO1C1 |
2.2.4. Broj lijekova u istodobnoj primjeni
Promatrajući odnos dobi pacijenata/korisnika lijeka i broja lijekova koje istodobno primjenjuje, u 2015. godini u mlađih dobnih skupina prevladava primjena samo jednog lijeka u terapiji odnosno prevenciji bolesti, što je u skladu s podacima iz prethodnih godina. Održan je trend prijava primjene većeg broja istodobno primijenjenih lijekova u odraslim i posebice starijim dobnim skupinama. Prilikom ocjene ovakvih prijava, posebno se vodi računa o mogućim interakcijama lijekova u istodobnoj primjeni.
Tablica 15. Broj lijekova koje pacijent/korisnik lijeka istodobno primjenjuje prema dobnim skupinama
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | Ukupno |
|---|---|---|---|---|---|
| 0-12 mjeseci | 44 | 4 | 4 | 5 | 57 |
| 1-2 godine | 84 | 4 | 0 | 0 | 88 |
| 3-6 godina | 37 | 10 | 0 | 0 | 47 |
| 7-14 godina | 70 | 13 | 0 | 0 | 83 |
| 15-17 godina | 15 | 8 | 2 | 0 | 25 |
| 18-40 godina | 366 | 134 | 52 | 6 | 558 |
| 41-64 godine | 514 | 368 | 187 | 92 | 1161 |
| 65-74 godina | 202 | 170 | 161 | 95 | 628 |
| 75-84 godina | 108 | 80 | 101 | 74 | 363 |
| > 85 godina | 15 | 12 | 19 | 10 | 56 |
| Neupisano | 247 | 90 | 28 | 88 | 453 |
| UKUPNO | 1702 | 893 | 554 | 370 | 3519 |
Slika 19. Broj prijava s 2-3 lijeka u istodobnoj primjeni prema dobnim skupinama u odrasloj i starijoj populaciji u razdoblju od 2005. do 2015. godine
Slika 20. Broj prijava s 4-5 lijekova u istodobnoj primjeni prema dobnim skupinama u odrasloj i starijoj populaciji u razdoblju od 2005. do 2015. godine
Slika 21. Broj prijava s više od 5 lijekova u istodobnoj primjeni prema dobnim skupinama u odrasloj i starijoj populaciji u razdoblju od 2005. do 2015. godine
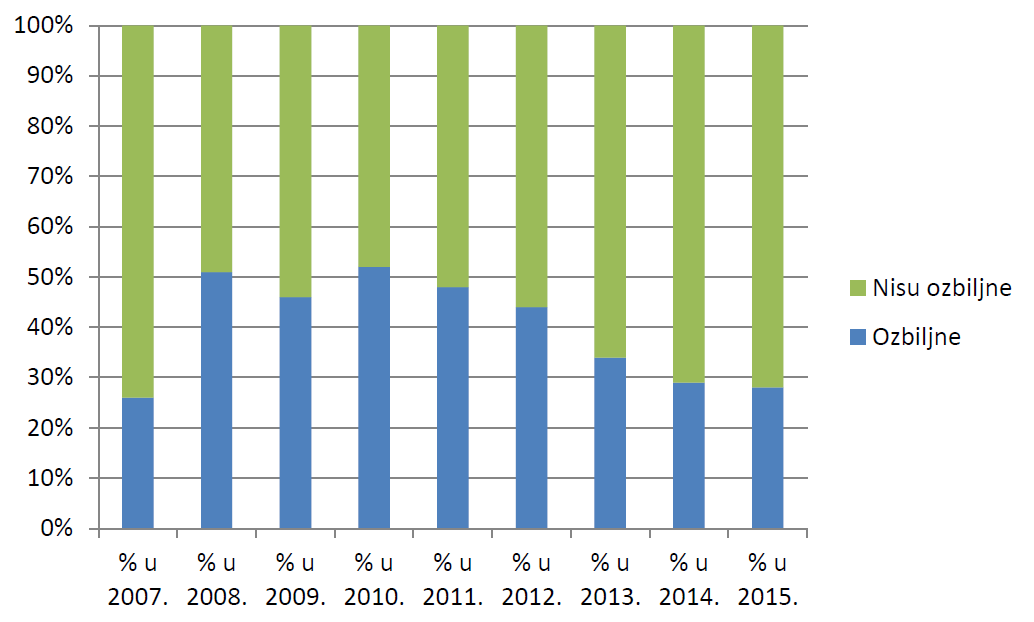
U 2015. godini zaprimljene su 984 prijave koje su ispunjavale najmanje jedan od kriterija prema kojima se nuspojava smatra ozbiljnom. Udio prijava koje ne ispunjavaju niti jedan od kriterija prema kojima se nuspojava smatra ozbiljnom (72%) značajno je veći od udjela prijava koji takve kriterije ispunjavaju (28%). Ovi podaci u skladu su s podacima iz 2014. godine, kada 71% prijava nije bilo ozbiljno, dok je njih 29% bilo ozbiljno.
Nuspojave koje zadovoljavaju najmanje jedan od navedenih kriterija smatraju se u regulatornom smislu ozbiljnima:
- ako je nuspojava uzrokovala smrt osobe
- ako nuspojava ugrožava život pacijenta/korisnika lijeka
- ako je nuspojava uzrokovala potrebu za bolničkim liječenjem (hospitalizaciju) ili produljenje već postojećeg bolničkog liječenja (produljenje hospitalizacije)
- ako je nuspojava uzrokovala trajni ili teški invaliditet ili nesposobnost
- ako je došlo do razvoja anomalije/mane od rođenja kod novorođenčeta zbog toga što je majka uzimala lijek tijekom trudnoće
- ako se radi o medicinski značajnom stanju koje se može smatrati ozbiljnim.
Ozbiljnim nuspojavama također se smatraju nuspojave navedene na listi važnih medicinskih događaja, odnosno IME listi (engl. Important Medical Events List) objavljenoj na internetskim stranicama HALMED-a. Ove nuspojave svrstavaju se u kategoriju medicinski značajnih ozbiljnih stanja.
Općenito niži udio ozbiljnih nuspojava među prijavljenim nuspojavama moguće je objasniti porastom broja prijava od strane farmaceuta kroz posljednjih nekoliko godina, koji se održao i u 2015. godini, te manjem udjelu prijava zaprimljenih iz bolničkih centara.
Slika 22. Kretanje udjela prijava prema ozbiljnosti u razdoblju od 2007. do 2015. godine
Iz tablice 16. i tablice 17. vidljivo je da je najveći broj ozbiljnih prijava zaprimljen od strane liječnika, dok farmaceuti i pacijenti/korisnici lijeka značajno više prijavljuju ne-ozbiljne nuspojave.
Tablica 16. Pregled ozbiljnih prijava prema tipu prijavitelja
| PRIJAVITELJI | Liječnici | Farmaceuti | Pacijenti/korisnici lijeka | Ostali zdravstveni radnici |
|---|---|---|---|---|
| Ukupan broj prijava iz izvora | 1781 | 1297 | 261 | 136 |
| Broj i udio ozbiljnih prijava | 734 (41%) | 158 (12%) | 55 (21%) | 25 (18%) |
| Broj i udio ne-ozbiljnih prijava | 1047 (59%) | 1139 (88%) | 206 (79%) | 111 (82%) |
Tablica 17. Udio u ukupnom broju ozbiljnih prijava prema prijaviteljima
| PRIJAVITELJI | Liječnici | Farmaceuti | Pacijenti/korisnici lijeka | Ostali zdravstveni radnici |
|---|---|---|---|---|
| Udio u ukupnom broju ozbiljnih prijava | 75% | 16% | 6% | 3% |
U tablici 18. prikazan je broj i udio nuspojava prema ishodu te je dana usporedba s 2014. godinom. Udio prijava koje nemaju podatak o ishodu nuspojave u 2015. godini je iznosio 25%, što je blago povećanje u odnosu na 2014. godinu, kada je taj udio iznosio 21%. Također se neznatno povećao i udio prijava u kojima je nuspojava u trenutku prijave bila u tijeku te iznosi 12%, dok je u 2014. godini iznosio 10%. Ovi podaci ukazuju na potrebu provođenja dodatnih aktivnosti s ciljem smanjenja udjela prijava u kojima nedostaju podaci o ishodu nuspojave. HALMED će, stoga, putem dodatnih edukativnih aktivnosti pokušati dodatno utjecati na prijavitelje kako bi se poboljšao ovaj pokazatelj kvalitete prijava.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u 61 slučaju. Od navedenih prijava, jedna je prijavljena od strane obitelji pacijenta, dok su ostale pristigle od strane zdravstvenih radnika. U najvećem se broju smrtnih slučajeva za koje se sumnja da su povezani s lijekovima radilo o pacijentima s teškom osnovnom bolešću, što dodatno otežava procjenu povezanosti lijeka i nuspojave sa smrtnim ishodom. Naime, velik broj lijekova za koje su prijavljene sumnje na nuspojavu sa smrtnim ishodom namijenjen je za liječenje zloćudnih bolesti (karcinomi) te za primjenu kod transplantiranih bolesnika, bolesnika sa srčanim bolestima i bolesnika s nasljednim, najčešće neizlječivim, metaboličkim bolestima. Zbog ozbiljnosti stanja kod kojih se primjenjuju ovi lijekovi, u predmetnim slučajevima teško je isključiti mogućnost utjecaja podležeće bolesti na smrtni ishod.
U najvećem broju prijava smrtnih slučajeva za koje se sumnja da su povezani s lijekovima radilo se o lijekovima iz ATK skupine L, odnosno lijekovima za liječenje zloćudnih bolesti i imunomodulatora. Budući da se tijekom 2015. godine za navedene lijekove provodilo nekoliko postmarketinških neintervencijskih ispitivanja te je praćenje sigurnosti njihove primjene bilo dodatno pojačano, broj prijava je veći nego prijašnjih godina.
Tablica 18. Broj i udio nuspojava prema ishodu zaprimljenih u 2015. godini u usporedbi s 2014. godinom
| Ishod nuspojave | 2015. | 2014. | % 2015. | % 2014. |
|---|---|---|---|---|
| Oporavak bez posljedica | 4656 | 4558 | 51 | 56 |
| Oporavak s posljedicama | 124 | 88 | 1 | 1 |
| Oporavak u tijeku | 965 | 994 | 11 | 12 |
| Nuspojava u tijeku | 1063 | 844 | 12 | 10 |
| Nepoznato | 2330 | 1674 | 25 | 21 |
2.2.7. Nuspojave po organskim sustavima
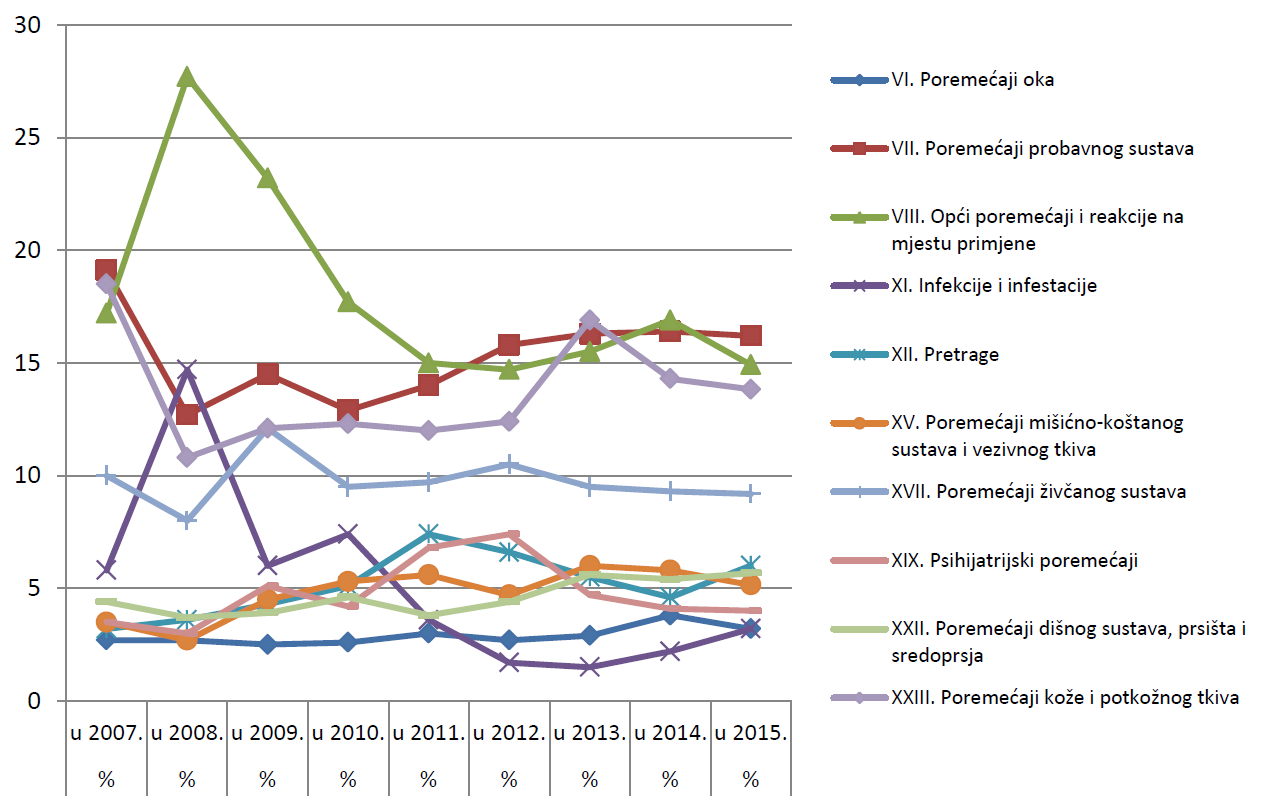
U promatranju organskih sustava za koje su prijave zaprimljene, nuspojave su navedene prema klasifikaciji organskih sustava prema MedDRA-i (MedDRA, engl. Medical Dictionary for Regulatory Activities - Medicinski rječnik za regulatorne poslove), koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom području. Najveći broj nuspojava u 2015. godini zabilježen je za organski sustav (SOC, engl. System Organ Class) Poremećaji probavnog sustava (16,23%), zatim za SOC Opći poremećaji i reakcije na mjestu primjene (14,92%) te za SOC Poremećaji kože i potkožnog tkiva (13,83%).
Tablica 19. Nuspojave prema klasifikaciji organskih sustava prema MedDRA-i u 2015. godini
| Organski sustav prema MedDRA-i (SOC) | Broj nuspojava u 2015. godini | Udio nuspojava u 2015. godini (%) |
|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 178 | 1,92 |
| II. Srčani poremećaji | 191 | 2,06 |
| III. Prirođeni, obiteljski i genetski poremećaji | 6 | 0,06 |
| IV. Poremećaji uha i labirinta | 140 | 1,51 |
| V. Endokrini poremećaji | 19 | 0,20 |
| VI. Poremećaji oka | 296 | 3,18 |
| VII. Poremećaji probavnog sustava | 1508 | 16,23 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 1387 | 14,92 |
| IX. Poremećaji jetre i žuči | 48 | 0,52 |
| X. Poremećaji imunološkog sustava | 134 | 1,44 |
| XI. Infekcije i infestacije | 301 | 3,24 |
| XII. Pretrage | 559 | 6,01 |
| XIII. Ozljede, trovanja i proceduralne komplikacije | 225 | 2,42 |
| XIV. Poremećaji metabolizma i prehrane | 128 | 1,38 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 479 | 5,15 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 79 | 0,85 |
| XVII. Poremećaji živčanog sustava | 854 | 9,19 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 8 | 0,09 |
| XIX. Psihijatrijski poremećaji | 372 | 4,00 |
| XX. Poremećaji bubrega i mokraćnog sustava | 146 | 1,57 |
| XXI. Poremećaji reproduktivnog sustava i dojki | 160 | 1,72 |
| XXII. Poremećaji dišnog sustava, prsišta i sredoprsja | 527 | 5,67 |
| XXIII. Poremećaji kože i potkožnog tkiva | 1285 | 13,83 |
| XXIV. Socijalne okolnosti | 24 | 0,26 |
| XXV. Operativni i medicinski postupci | 11 | 0,12 |
| XXVI. Krvožilni poremećaji | 229 | 2,46 |
| UKUPNO | 9294 | 100,0 |
Slika 23. Prikaz kretanja nuspojava iz deset najzastupljenijih organskih sustava prema podacima u 2015. godini u razdoblju od 2007. do 2015. godine
Tablica 20. Ukupni broj prijava klasificiranih prema organskim sustavima (SOC) prema prijaviteljima u 2015. godini
| Mjesto po broju prijava po SOC-u | Liječnici | Farmaceuti | Pacijenti | |||
|---|---|---|---|---|---|---|
| SOC | Broj prijava | SOC | Broj prijava | SOC | Broj prijava | |
| 1. | VIII | 816 | VII | 650 | VIII | 144 |
| 2. | VII | 675 | XXIII | 587 | VII | 131 |
| 3. | XXIII | 584 | VIII | 366 | XVII | 114 |
Kako je vidljivo iz tablice 20., liječnici su u 2015. godini najčešće prijavljivali nuspojave svrstane u SOC VIII. Opći poremećaji i reakcije na mjestu primjene. Na drugom su mjestu nuspojave svrstane u SOC VII. Poremećaji probavnog sustava, a na trećem mjestu nuspojave svrstane u SOC XXIII. Poremećaji kože i potkožnog tkiva. Ovi podaci djelomično se razlikuju od podataka za 2014. godinu, kada su se na drugom mjestu nalazile nuspojave svrstane u SOC Poremećaji kože i potkožnog tkiva, a na trećem mjestu nuspojave svrstane u SOC Poremećaji probavnog sustava.
Farmaceuti su u 2015. godini najčešće prijavljivali nuspojave svrstane u SOC VII. Poremećaji probavnog sustava, na drugom mjestu nalaze se nuspojave svrstane u SOC XXIII. Poremećaji kože i potkožnog tkiva, dok su na trećem mjestu nuspojave svrstane u SOC VIII. Opći poremećaji i reakcije na mjestu primjene.
Pacijenti/korisnici lijeka su, kao i liječnici, u 2015. godini najčešće prijavljivali nuspojave svrstane u SOC VIII. Opći poremećaji i reakcije na mjestu primjene. Na drugom mjestu nalaze se nuspojave svrstane u SOC VII. Poremećaji probavnog sustava, dok se na trećem mjestu, za razliku od prijava zaprimljenih od zdravstvenih radnika, nalaze nuspojave svrstane u SOC XVII. Poremećaji živčanog sustava. Izravne prijave od pacijenata/korisnika lijeka pridonose boljoj obuhvatnosti svih nuspojava koje utječu na kvalitetu života pojedinih pacijenata/korisnika lijeka, što je potrebno uzeti u obzir posebice prilikom detekcije i ocjene sigurnosnih signala.
Podaci o nuspojavama prijavljenima od farmaceuta i pacijenata/korisnika lijeka prema organskim sustavima za 2015. godinu nisu se značajno promijenili u odnosu na podatke za 2014. godinu.
2.2.8. Najčešće prijavljene nuspojave u 2015. godini
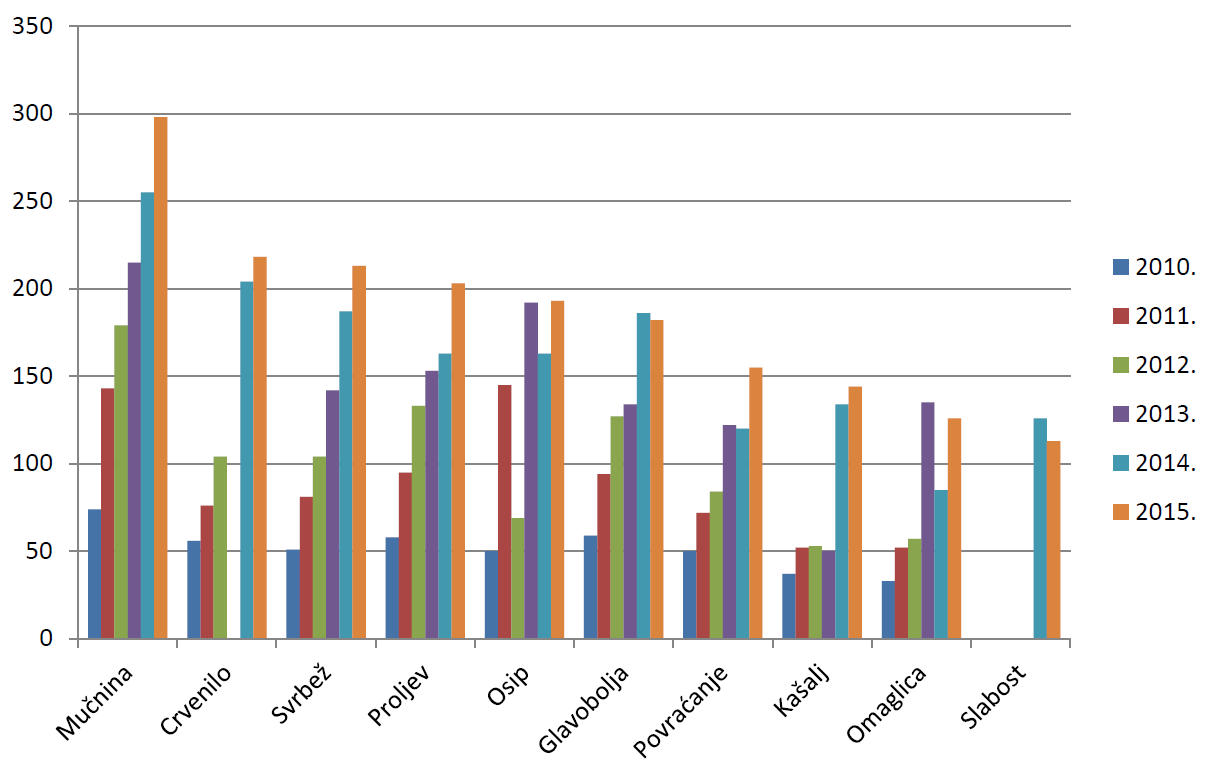
U 2015. godini najčešće su prijavljene nuspojave kao što su mučnina, crvenilo, svrbež, proljev i osip, što su nuspojave karakteristične za klasične sintetske lijekove i što je u skladu s podacima iz prethodnih godina. Riječ je o nuspojavama koje su prijaviteljima dobro uočljive, jasno vremenski povezane s primjenom lijeka (javljaju se ubrzo nakon početka primjene lijeka, a najčešće nestaju nakon prestanka primjene lijeka) te nerijetko značajno smanjuju kvalitetu života pacijenta/korisnika lijeka, iako regulatorno ne spadaju u ozbiljne nuspojave. U tablici 21. navedene su samo one nuspojave koje su prijavljene više od 100 puta. Također, na slici 24. grafički je prikazano kretanje deset najčešće prijavljenih nuspojava u 2015. godini u odnosu na razdoblje od 2010. do 2015. godine.
Tablica 21. Najčešće prijavljene nuspojave u 2015. godini
| Nuspojava | Broj prijava u 2015. godini |
|---|---|
| Mučnina | 298 |
| Crvenilo | 218 |
| Svrbež | 213 |
| Proljev | 203 |
| Osip | 193 |
| Glavobolja | 182 |
| Povraćanje | 155 |
| Kašalj | 144 |
| Omaglica | 126 |
| Slabost | 113 |
| Umor | 107 |
| Dispneja | 105 |
| Bol u trbuhu | 105 |
Slika 24. Grafički prikaz kretanja deset najčešće prijavljenih nuspojava u 2015. godini u odnosu na razdoblje od 2010. do 2015. godine
*podaci nisu prikazani za godine u kojima se predmetne nuspojave nisu nalazile među deset najčešće prijavljenih
3. Pregled sigurnosnih pitanja u 2015. godini
3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2015. godini
3.1.1. Lijekovi koji sadrže mikofenolatnu kiselinu
Tijekom 2015. godine na razini Europske unije provedena je ocjena lijekova koji sadrže mikofenolatnu kiselinu, mofetilmikofenolat ili natrijev mikofenolat zbog zabrinutosti oko rizika od teratogenih učinaka na plod i spontanih pobačaja ako se lijek primjenjuje u trudnoći.
Mikofenolatna kiselina je imunosupresiv - lijek koji potiskuje djelovanje imunološkog sustava, koji je prirodna obrana organizma. Ovaj lijek odobren je za primjenu s drugim lijekovima za sprječavanje odbacivanja presađenog bubrega, srca ili jetre.
Rizik primjene mikofenolatne kiseline u trudnoći od ranije je poznat te su podaci o njemu već bili uvršteni u sažetak opisa svojstava lijeka i uputu o lijeku. Ove pojačane preporuke za sprječavanje trudnoće uslijedile su nakon redovite ponovne ocjene koristi i sigurnosti primjene ovih lijekova, u kojoj su ocijenjeni dokazi o riziku od prirođenih mana i spontanih pobačaja u slučajevima u kojima su trudnice bile izložene ovom lijeku.
Ocijenjeno je da je, ako je trudnica izložena mikofenolatnoj kiselini, bilo da ga osobno uzima ili putem nezaštićenog spolnog odnosa s muškarcem koji uzima ovaj lijek, izgledno da će to naštetiti djetetu u razvoju. Otprilike polovica trudnoća kod žena koje uzimaju ovaj lijek završava pobačajem, a otprilike četvrtina preživjelih beba rađa se s prirođenim manama. Zbog toga su uvedene nove kontraindikacije i upozorenja. Od sada se mikofenolatna kiselina se ne smije primjenjivati tijekom trudnoće, osim ako ne postoji prikladna zamjenska terapija za sprječavanje odbacivanja presatka. Mikofenolatna kiselina se ne smije primjenjivati kod žena reproduktivne dobi koje ne koriste visoko učinkovitu kontracepciju. Kod žena reproduktivne dobi liječenje mikofenolatnom kiselinom se ne smije započeti prije nego što se predoči nalaz testa na trudnoću kako bi se isključila mogućnost nehotične primjene tijekom trudnoće. Također su uvedene nove preporuke za testiranje na trudnoću, preporuke za kontracepciju za žene i muškarce i dodatne mjere opreza.
Zbog navedenog sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a, izmijenjeni su sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije, a nositeljima odobrenja uvedena je obveza da za bolesnike i zdravstvene radnike izrade edukacijske materijale.
3.1.2. Lijekovi koji sadrže SGLT2 inhibitore
Tijekom 2015. godine na razini Europske unije provedena je ocjena lijekova koji sadrže SGLT2 inhibitore zbog zabrinutosti oko rizika od dijabetičke ketoacidoze povezane s liječenjem ovim lijekovima.
Inhibitori suprijenosnika natrija-glukoze 2 (engl. sodium-glucose co-transporter 2 inhibitors, SGLT2 inhibitors) su lijekovi koji se koriste u liječenju dijabetesa (šećerne bolesti) tipa 2. Djelujući u bubrezima, ovi lijekovi dovode do toga da se više glukoze izlučuje u mokraći, čime se smanjuje razina glukoze u krvi. U SGLT2 inhibitore ubrajaju se sljedeće djelatne tvari: dapagliflozin, empagliflozin i kanagliflozin. Navedene djelatne tvari se u lijekovima za liječenje dijabetesa mogu nalaziti kao jedina djelatna tvar ili u kombinaciji s metforminom.
Dijabetička ketoacidoza je ozbiljna komplikacija dijabetesa. Simptomi uključuju brzi gubitak tjelesne mase, mučninu ili povraćanje, bol u trbuhu, pojačano žeđanje, ubrzano i duboko disanje, smetenost, neobičnu pospanost ili umor, sladak zadah iz usta, okus u ustima koji je sladak ili nalik metalu i promijenjeni miris mokraće i znoja.
Rijetki slučajevi dijabetičke ketoacidoze, uključujući i one opasne po život, javili su se u bolesnika koji su uzimali SGLT2 inhibitore u liječenju dijabetesa tipa 2, a dio tih slučajeva bio je atipičan zato što bolesnici nisu imali razine šećera u krvi onoliko visoke koliko bi bilo očekivano. Atipična prezentacija dijabetičke ketoacidoze može odgoditi postavljanje dijagnoze i liječenje. Na temelju provedene ocjene donesene su nove preporuke i upozorenja. Zbog ovog rizika, zdravstveni radnici trebaju razmotriti mogućnost ketoacidoze u bolesnika liječenih SGLT2 inhibitorima koji imaju simptome koji odgovaraju ketoacidozi, čak i onda kada razine šećera u krvi nisu visoke.
Zbog navedenog sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.1.3. Lijekovi koji sadrže visoke doze ibuprofena ili deksibuprofena
Tijekom 2014. i 2015. godine na razini Europske unije provedena je ocjena lijekova koji sadrže visoke doze ibuprofena ili deksibuprofena zbog zabrinutosti oko kardiovaskularnih rizika povezanih s primjenom ovih lijekova.
Ibuprofen je jedan od najšire primjenjivanih lijekova za liječenje simptoma boli i upale, koji ima dobro poznati sigurnosni profil, osobito pri uobičajenim dozama. Velika većina bolesnika ibuprofen uzima u nižim dozama i kroz kraća vremenska razdoblja, za što ne postoje naznake da bi postojao kardiovaskularni rizik. Uobičajena doza za odrasle i djecu stariju od 12 godina je 200 do 400 mg, tri do četiri puta na dan, prema potrebi.
Kardiovaskularni rizici ocjenjivali su se za visoke doze ibuprofena (2400 mg dnevno ili više), koje se uzima redovito, kroz dugo vremensko razdoblje. Ibuprofen je u lijekovima prisutan kao mješavina dviju molekula koje su enantiomeri (međusobni zrcalni odrazi). Deksibuprofen, aktivni enantiomer, ponekad je dostupan zasebno te je stoga također uključen u ovaj pregled. Visoka doza deksibuprofena je 1200 mg ili više dnevno.
Ocjenom je zaključeno da u bolesnika koji dugoročno uzimaju visoke doze ibuprofena (2400 mg ili više dnevno) postoji malo povećanje kardiovaskularnog rizika, uključujući rizik od srčanog i moždanog udara. Taj rizik je usporediv s rizikom koji je uočen uz primjenu nekih drugih nesteroidnih protuupalnih lijekova, uključujući COX-2 inhibitore i diklofenak. Nije uočen povišen kardiovaskularni rizik uz primjenu ibuprofena u dozama do 1200 mg dnevno, što je najviša doza koja se uobičajeno koristi kod lijekova koji se uzimaju na usta, a koji se izdaju bez recepta u Europskoj uniji.
Zbog kardiovaskularnog rizika visoke doze ibuprofena potrebno je izbjegavati u bolesnika s ozbiljnim podležećim srčanim ili krvožilnim stanjima, kao što su zatajenje srca, srčane bolesti i problemi s cirkulacijom, kao i u bolesnika koji su preboljeli srčani ili moždani udar. Nadalje, prije započinjanja dugoročnog liječenja ibuprofenom liječnici trebaju pažljivo ocijeniti rizične čimbenike za srčane ili krvožilne bolesti, osobito ako je potrebna primjena visokih doza ibuprofena. Rizični čimbenici za ova stanja uključuju pušenje, visoki krvni tlak, dijabetes i visoki kolesterol u krvi.
Zbog navedenog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.1.4. Lijekovi koji sadrže ambroksol ili bromheksin
Tijekom 2015. godine na razini Europske unije provedena je ocjena lijekova koji sadrže ambroksol ili bromheksin zbog zabrinutosti oko alergijskih reakcija i teških kožnih nuspojava.
Ambroksol je, kao i bromheksin, ekspektorans (lijek koji se koristi za olakšavanje iskašljavanja). Bromheksin se u tijelu većinski pretvara u ambroksol. Neki se oblici ovih lijekova koriste za liječenje poremećaja disanja u nedonoščadi i novorođenčadi ili za poticanje sazrijevanja fetalnih pluća.
Ocjena je započeta zbog prijavljenih slučajeva alergijskih reakcija i teških kožnih nuspojava uz primjenu ovih lijekova. Ocjenom je potvrđeno postojanje od ranije poznatog rizika od alergijskih reakcija te je utvrđeno da postoji i nizak rizik od teških kožnih nuspojava. Broj prijava nuspojava teških alergijskih reakcija i teških kožnih nuspojava je nizak, a učestalost tih nuspojava nije poznata. U slučaju alergijskih reakcija ili kožnih nuspojava kao što su oticanje kože ili osip bolesnici trebaju odmah prekinuti uzimanje lijeka i javiti se liječniku.
Zbog navedenog sigurnosnog pitanja javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažeci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile gore navedene informacije.
3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2015. godini
3.2.1. HALMED među deset najuspješnijih na svijetu prema broju prijava sumnji na nuspojave na milijun stanovnika
Prema podacima Uppsala Monitoring Centra (UMC) iz srpnja 2015. godine, Republika Hrvatska uvrstila se u prvih deset zemalja u svijetu, za razdoblje od 1. lipnja 2014. godine do 31. svibnja 2015. godine, prema broju zaprimljenih prijava sumnji na nuspojave lijekova na milijun stanovnika. Slika 25. preuzeta je iz časopisa Uppsala Reports iz srpnja 2015. godine
Slika 25. Broj prijava sumnji na nuspojave na milijun stanovnika u bazi Svjetske zdravstvene organizacije (UMC - VigiBase), za razdoblje od 1. lipnja 2014. godina do 31. svibnja 2015. godine.
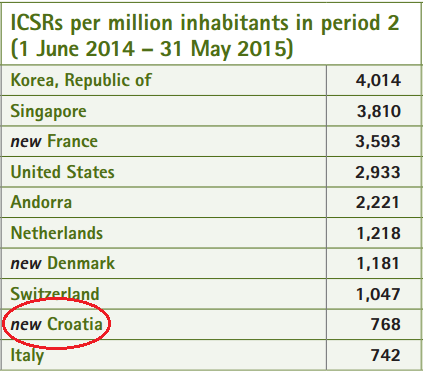
Ovaj uspjeh rezultat je zajedničkih napora HALMED-a i svih zdravstvenih radnika, pacijenata/korisnika lijeka i nositelja odobrenja za stavljanje lijeka u promet koji redovito prijavljuju sumnje na nuspojave. Veći broj prijava indikator je kvalitete sustava prijavljivanja te svaka dodatna prijava znači dodatnu informaciju o lijeku za pacijente/korisnike lijeka i zdravstvene radnike, što u konačnici dovodi do sigurnije primjene lijekova.
3.2.2. Redizajniran portal HALMED-a
Krajem 2015. godine pušten je u rad redizajnirani portal HALMED-a. Time je velik broj korisnih informacija iz djelokruga rada HALMED-a postao dostupan na još pristupačniji način, pri čemu su u obzir uzete potrebe i zahtjevi pacijenata, zdravstvenih radnika, predstavnika industrije te drugih interesnih skupina HALMED-a. U sklopu redizajna portala određen je novi vizualni identitet HALMED-a, razvijeno je preglednije i intuitivnije korisničko sučelje, omogućen prilagođeni pristup različitim interesnim skupinama HALMED-a te su poboljšane funkcionalnosti portala i organizacija velikog broja informacija iz djelokruga rada HALMED-a. Uz postojeće sadržaje, portal je dobio i niz novih korisnih sadržaja, prvenstveno iz područja praćenja sigurnosti primjene lijekova.
Nakon punih 12 godina HALMED-ove aktivne brige za zaštitu i promicanje javnog zdravlja u Republici Hrvatskoj, cilj redizajna portala bio je još više približiti i otvoriti HALMED pacijentima i svim ostalim interesnim skupinama.
Redizajnom portala poboljšane su postojeće te omogućene nove funkcionalnosti i sadržaji:
- Novim dizajnom najvažniji su sadržaji i alati smješteni na početnu stranicu.
- Također, redizajnom je omogućeno korisnicima da uz samo jedan klik s naslovnice dođu do što većeg broja informacija.
- Pristup sadržajima prilagođen je trima ključnim interesnim skupinama: pacijentima i javnosti, zdravstvenim radnicima te predstavnicima industrije.
- Više od 4.800 lijekova odobrenih za stavljanje u promet u Republici Hrvatskoj dostupno je u bazi lijekova HALMED-a. Za svaki od njih moguće je preuzeti uputu o lijeku i sažetak opisa svojstava lijeka koji sadrže važne informacije za njihovu primjenu.
- Pomoću portala korisnici mogu provjeriti informacije o dostupnosti lijekova u prometu u Republici Hrvatskoj.
- Pacijenti i zdravstveni radnici, ali i svi ostali korisnici, mogu izravno HALMED-u prijaviti svaku sumnju na nuspojavu lijeka uz pomoć lako dostupnih obrazaca ili jednostavne on-line aplikacije.
- Putem portala moguće je na jednostavan način prijaviti i svaku sumnju u neispravnost lijeka ili medicinskog proizvoda ili sumnju u krivotvorinu.
- Na portalu je dostupan niz različitih publikacija koje HALMED redovito objavljuje, kao što su godišnja izvješća o prijavama sumnji na nuspojave lijekova te godišnja i višegodišnja izvješća o potrošnji lijekova.
- Prijavom na newsletter ili RSS kanale korisnici mogu redovito primati sve novosti iz područja lijekova i medicinskih proizvoda koje se svakodnevno objavljuju na portalu.
Izravan i prilagođen pristup informacijama
Portalu HALMED-a moguće je pristupiti na tri različita načina, prilagođena svakoj od tri glavne interesne skupine HALMED-a: pacijentima i javnosti, zdravstvenim radnicima te predstavnicima industrije. Sadržaji koji su osobito relevantni za svaku pojedinu interesnu skupinu uz pomoć prilagođenog pristupa posebno su istaknuti i brže dostupni.
Jednako tako, cjelokupnom sadržajnom koncepcijom portala osiguran je još izravniji pristup najčešće pretraživanim sadržajima iz djelokruga rada HALMED-a. Na taj način korisnici uz jedan klik mogu pristupiti bazama lijekova, medicinskih proizvoda i dozvola za promet i proizvodnju, kao i informacijama o dostupnosti lijekova u prometu te obrascima za prijavu sumnji na nuspojave, štetne događaje i neispravnosti u kakvoći, ali i velikom broju informativnih tekstova o lijekovima i medicinskim proizvodima.
Pacijenti u središtu
Olakšanim pristupom još većem broju informacija iz područja lijekova i medicinskih proizvoda, pacijenti se mogu još aktivnije uključiti u praćenje sigurnosti lijekova i medicinskih proizvoda. Za svaki lijek odobren za stavljanje u promet u Republici Hrvatskoj, pacijenti u bazi lijekova HALMED-a mogu pronaći uputu o lijeku, koja sadrži sve informacije nužne za njegovu pravilnu i sigurnu primjenu, te provjeriti informacije o njegovoj dostupnosti u prometu u RH. Jednako tako, pacijentima su lako dostupne upute za prijavljivanje sumnji na nuspojave, kao i on-line aplikacija za prijavu sumnji na nuspojave lijekova. Također, putem portala HALMED-a pacijenti mogu pristupiti europskoj i svjetskoj bazi sumnji na nuspojave, ali i pratiti sve novosti o sigurnosti primjene lijekova i medicinskih proizvoda.
3.2.3. Inventivni načini promoviranja važnosti pravilne primjene lijekova i prijavljivanja sumnji na nuspojave
Tijekom 2015. godine HALMED je u suradnji s kazalištem Mala scena promovirao važnost pravilne primjene lijekova i prijavljivanja sumnji na nuspojave. Naime, uz sponzorsku i stručnu potporu HALMED-a, u veljači 2015. godine je kazalištu Mala scena postavljena predstava "Ne, ti ne! ili o drukčijatosti", koja problematizira stigmu oboljelih od epilepsije te način nošenja s ovom bolesti.
Predstava je prvenstveno namijenjena djeci školskog uzrasta i mladima te predstavlja tek jedan od vidova suradnje HALMED-a i kazališta Mala scena putem koje se promiče važnost pravilne primjene lijekova i prijavljivanja sumnji na nuspojave lijekova. Uz informativne letke o prijavljivanju nuspojava koji su distribuirani gledateljima predstave prilikom svake izvedbe, pripremljen je i pedagoški paket, koji nadopunjuje produkciju i omogućuje nastavak dijaloga nakon odgledane predstave, a sadrži informacije o nuspojavama lijekova te o načinima na koje je moguće prijaviti sumnju na nuspojavu lijeka.
U cilju educiranja i informiranja korisnika lijekova, HALMED je prepoznao kazalište kao uspješni kanal za osvješćivanje i komuniciranje važnosti pravilne primjene lijekova i prijavljivanja nuspojava, a Malu scenu kao odgovarajućeg partnera u približavanju i promicanju ovih poruka mlađoj i odrasloj populaciji (slika 26.).
Slika 26. Glumci predstave "Ne, ti ne! ili o drukčijatosti"






