Zašto su cjepiva protiv bolesti COVID-19 potrebna i kada se odobravaju?
Zašto su cjepiva za sprječavanje bolesti COVID-19 potrebna?
- Cjepiva protiv bolesti COVID-19 namijenjena su sprječavanju bolesti COVID-19 uzrokovane virusom SARS-CoV-2.
- Trenutačno pandemijsko širenje bolesti COVID-19 predstavlja globalnu krizu s velikim zdravstvenim, socijalnim i ekonomskim utjecajem.
- Bolest COVID-19 može prouzročiti smrt ili razvoj daljnjih bolesti s još nepoznatim dugoročnim zdravstvenim posljedicama za ljude sve životne dobi, uključujući i inače zdrave pojedince.
- Potrebna su sigurna i djelotvorna cjepiva kako bi se pojedinci zaštitili od bolesti COVID-19, posebice zdravstveni radnici i rizične skupine, poput starijih osoba i kroničnih bolesnika.
Koja su cjepiva protiv bolesti COVID-19 odobrena i kako djeluju?
- U Europskoj uniji, pa tako i u Republici Hrvatskoj, odobrenje za stavljanje u promet ima više cjepiva. Pregled statusa svih lijekova i cjepiva za COVID-19 u postupcima ocjene i odobravanja koji se provode pri Europskoj agenciji za lijekove (EMA) i Europskoj komisiji (EK) ili su završeni dostupan je ovdje.
- Zbog izvanrednih okolnosti prouzročenih pandemijom, iznimni napori su uloženi u razvoj i proučavanje cjepiva protiv bolesti COVID-19 kako bi se predmetna cjepiva odobrila i bila dostupna što prije.
- Cjepiva djeluju na način da pripreme imunološki sustav (prirodnu obranu tijela) na prepoznavanje i obranu tijela od određene bolesti. Većina ispitivanja vezanih uz cjepiva protiv bolesti COVID-19 uključuju pripremu tijela na obranu od tzv. proteina šiljka (engl. spike protein) pomoću kojeg koronavirus ulazi u stanice tijela i uzrokuje bolest COVID-19. Kada osoba primi cjepivo, ono će potaknuti imunološki odgovor. Ako u narednom razdoblju cijepljena osoba dođe u kontakt s virusom SARS-CoV-2, imunološki sustav će prepoznati virus i bit će spreman za napad, čime štiti osobu od bolesti COVID-19.
Koji se postupak i metode koriste za razvoj i odobravanje cjepiva protiv bolesti COVID-19?
- Jednako kao i drugi lijekovi, cjepiva protiv bolesti COVID-19 razvijaju se na način da ispunjavaju stroge zakonske zahtjeve farmaceutske kakvoće, sigurnosti primjene i djelotvornosti.
- Djelotvornost cjepiva protiv bolesti COVID-19 prvo se određuje putem laboratorijskih ispitivanja, uključujući testiranje na životinjama, a zatim na ljudskim dobrovoljcima (Slika 1.).
Slika 1.: Pregled razvoja i davanja odobrenja za stavljanje cjepiva u promet
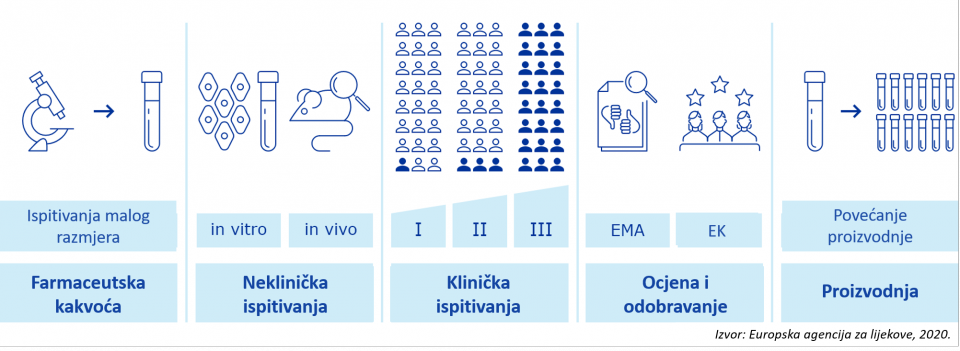
- Prije davanja odobrenja za stavljanje cjepiva u promet, cjepiva se u EU-u ocjenjuju prema istim visokim kriterijima kao i svi drugi lijekovi.
- Ono što je različito za cjepiva protiv bolesti COVID-19 je puno brži razvoj i postupak potencijalnog davanja odobrenja za stavljanje cjepiva u promet od uobičajenog zbog izvanredne javnozdravstvene situacije.
- EMA je uspostavila posebnu Radnu skupinu za COVID-19 (EMA pandemic Task Force, COVID-ETF) i pripremila pregled ubrzanih regulatornih postupaka u svrhu znanstvene ocjene dobivenih zahtjeva visoke kvalitete od strane zainteresiranih proizvođača u što kraćem roku, osiguravajući pouzdana znanstvena mišljenja.
- EK koristi dostupne mehanizme kako bi se ubrzao postupak davanja odobrenja za stavljanje u promet svih potencijalnih cjepiva na području EU-a spremnih za primjenu, no to je moguće samo ako EMA zaprimi valjane znanstvene dokaze koji potvrđuju da su koristi pojedinog cjepiva veće od bilo kakvih rizika.
- Proizvođači cjepiva koriste uspostavljene proizvodne pogone za izradu sigurnih i djelotvornih cjepiva. Nadalje, kontinuirano istražuju nove pristupe proizvodnji i razvoju cjepiva, a neki od dosadašnjih napredaka na tom području primjenjuju se i na razvoj cjepiva protiv bolesti COVID-19.
- Neka se cjepiva protiv bolesti COVID-19 razvijaju pomoću novih metoda za koje se očekuje da će povećati količinu i brzinu proizvodnje u usporedbi s drugim vrstama cjepiva, poboljšati stabilnost proizvoda i osigurati imunološku reakciju tijela u borbi protiv zaraze.
- Ostala cjepiva razvijaju se putem postojećih metoda, korištenih u cjepivima protiv drugih bolesti, što bi moglo olakšati uporabu već postojećih proizvodnih pogona za proizvodnju cjepiva protiv bolesti COVID-19 u većim količinama nego za druge vrste cjepiva.
Zašto je razvoj započeo tek nakon proglašenja pandemije?
- Cjepiva se mogu početi razvijati tek kada je poznat uzročnik zaraze. Budući da je koronavirus SARS-CoV-2 novi oblik virusa koji nije bio otkriven ranije, razvoj cjepiva za zaštitu od bolesti COVID-19 mogao je započeti tek nakon što se virus pojavio te mu je analiziran genetski sastav. Također, razvoj cjepiva temelji se na iskustvu i tehnologijama korištenim za druga cjepiva.
Kada se cjepiva odobravaju?
- Pregled statusa lijekova i cjepiva za COVID-19 u postupcima ocjene i odobravanja koji se trenutačno provode pri EMA-i i EK-u ili su završeni dostupan je ovdje.
- Općenito, nakon zaprimanja kliničkih podataka za cjepiva protiv bolesti COVID-19, ocjenitelji u ubrzanom postupku provode znanstvenu ocjenu sigurnosti, djelotvornosti i kakvoće cjepiva kako bi mogli donijeti zaključak postoje li čvrsti znanstveni dokazi na temelju kojih se za cjepiva može preporučiti davanje odobrenja.
- Konačno mišljenje EMA-e dostavlja se Europskoj komisiji, koja, u slučaju da znanstveni dokazi potvrđuju pozitivnu ocjenu koristi u odnosu na rizike za neko od cjepiva, u najkraćem mogućem roku izdaje odobrenje za stavljanje cjepiva u promet važeće za čitavu Europsku uniju.
Koja je vrsta i količina podataka potrebna da bi se odobrilo sigurno i djelotvorno cjepivo?
- Proizvođači cjepiva protiv bolesti COVID-19 dostavljaju EMA-i potrebne opsežne podatke o cjepivu. EMA potom provodi ocjenu dokumentacije kako bi se donijeli znanstveni zaključci o sigurnosti, djelotvornosti i kakvoći cjepiva te utvrdila njegova prikladnost za cijepljenje kod ljudi.
- Podaci pokazuju djelotvornost cjepiva u zaštiti od bolesti COVID-19 (djelotvornost cjepiva u kliničkim uvjetima) te njegovu sigurnost primjene. Djelotvornost se mjeri promatranjem koliko dobro cjepivo djeluje u ispitivanjima, primjerice koliko dobro cjepivo utječe na sprječavanje simptomatske bolesti. Te mjere djelotvornosti nazivaju se mjere ishoda (engl. endpoints). Mjere ishoda djelotvornosti potrebne su s obzirom na to da je COVID-19 nova bolest te ne postoje poznati pokazatelji (poput razine protutijela u krvi) koji bi mogli predvidjeti zaštitu.
- Zahtjevi vezani uz sigurnost primjene za cjepiva protiv bolesti COVID-19 jednaki su zahtjevima za bilo koje drugo cjepivo u EU-u te se ne snižavaju u kontekstu pandemije.
- Podaci dostavljeni u zahtjevu za davanje odobrenja za stavljanje cjepiva protiv bolesti COVID-19 u promet moraju sadržavati sljedeće informacije:
- Skupina ljudi kojima će se dati cjepivo
- Farmaceutska kakvoća cjepiva, uključujući informacije o značajkama i čistoći komponenata cjepiva, kao i njegov sadržaj te biološka aktivnost (jačina)
- Podaci o svim koracima proizvodnje i poduzetim provjerama koje osiguravaju da je svaka serija cjepiva iste kakvoće
- Usklađenost s međunarodnim zahtjevima za laboratorijska ispitivanja, proizvodnju cjepiva i provođenje kliničkih ispitivanja (dobra laboratorijska praksa, dobra klinička praksa i dobra proizvođačka praksa)
- Vrste imunoloških odgovora potaknutih cjepivom
- Djelotvornosti uočene kod ispitanika kojima se daje cjepivo
- Uočene nuspojave cjepiva, uključujući podatke o posebnim skupinama poput starijih ljudi ili trudnica
- Informacije koje će se prikupljati iz ispitivanja praćenja nakon izdavanja odobrenja za stavljanje cjepiva u promet (primjerice dugoročni podaci o sigurnosti cjepiva ili imunizaciji)
- Dokumentacija proizvođača cjepiva koja se pruža pacijentima i zdravstvenim radnicima (primjerice sažetak opisa svojstva cjepiva, uputa o lijeku, označivanje proizvoda), a čiju ocjenu provode znanstvena povjerenstva EMA-e
- Način na koji će se upravljati rizicima i pratiti ih nakon izdavanja odobrenja za stavljanje cjepiva u promet; Plan upravljanja rizikom (RMP), dokument koji sadrži informacije o svim mogućim (poznatim ili potencijalnim) rizicima vezanih uz cjepivo, način na koji će se upravljati rizicima i pratiti ih nakon što se cjepivo odobri te informacije koje se namjeravaju prikupiti iz ispitivanja praćenja nakon izdavanja odobrenja za stavljanje cjepiva u promet. Plan upravljanja rizikom ocjenjuje Povjerenstvo za ocjenu rizika na području farmakovigilancije (PRAC) pri EMA-i.
Koliko će dugo trajati imunitet nakon cijepljenja?
- Budući da je riječ o novom virusu, ne postoji dovoljno znanja o tome koliko će dugo trajati imunitet tijela nakon cijepljenja protiv bolesti COVID-19.
- Podaci koji će se prikupiti iz dugoročnih studija o imunogenosti i djelotvornosti bit će korišteni u budućim strategijama cijepljenja.
Hoće li cijepljenje biti djelotvorno ako virus mutira?
- Obično virusi mutiraju jer im se mijenja genetski materijal. To se događa na različitim razinama za različite viruse, a mutacije ne moraju nužno utjecati na djelotvornost cjepiva protiv virusa. Neka cjepiva protiv virusnih bolesti ostaju djelotvorna mnogo godina i pružaju dugotrajnu zaštitu, poput cjepiva protiv ospica ili rubeole. S druge strane, za bolesti poput gripe, sojevi virusa mutiraju često i do te mjere da je sastav cjepiva potrebno prilagoditi svake godine kako bi ono bilo učinkovito.
- Znanstvena zajednica i regulatorna tijela nadgledat će mijenja li se koronavirus Sars-CoV-2 tijekom vremena te mogu li dostupna cjepiva pružati odgovarajuću zaštitu protiv mutiranih inačica virusa.